PORTAL
DE ESTUDOS EM QUÍMICA
|
|
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
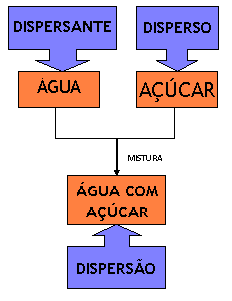
Neste exemplo podemos definir alguns conceitos tais como:
O açúcar (C6H12O6) que será dissolvido chama-se disperso, a água (H2O) que dissolverá o açúcar chama-se dispersante ou dispergente e a mistura água com açúcar é denominada de dispersão.
Resumindo temos:
CLASSIFICAÇÃO DAS DISPERSÕES
Se você adicionar um pouco de sal a um copo de água e agitar, notará que o sal irá se dissolver e, a partir dessa mistura, formar uma solução aquosa. No entanto, se a mesma experiência for feita com um pouco de areia fina, o resultado será muito diferente. Como a areia não se dissolve em água, irá depositar-se no fundo do recipiente, logo após o término da agitação.
A mistura de água e areia, no momento da agitação, constitui um bom exemplo de suspensão.
Mesmo através da filtração, seria possível observar uma diferença importante entre esses dois tipos de mistura: as suspensões podem ser filtradas; as soluções, não.
É evidente que essa diferença de comportamento entre as soluções e as suspensões se deve ao tamanho da partícula dispersa. Enquanto que os enormes grãos de areia, a maioria visíveis a olho nu, ficam presos no papel de filtro, os invisíveis íons Na+ e Cl- possuem dimensões tão reduzidas que atravessam facilmente os poros do filtro.
Há uma ampla variedade de valores entre o diâmetro médio dos íons e das moléculas comuns e o diâmetro médio de corpos maiores como os da areia, constituídos de sílica (SiO2). Em outras palavras, as partículas dispersas num meio sólido, líquido ou gasoso possuem tamanhos muito diferentes.
Para muitos pesquisadores, os dispersos com diâmetros médios entre 1,0 nm e 1000 nm constituem fronteiras gerais para uma classificação das misturas. Assim, partículas com diâmetro inferior a 1,0 nm encontram-se em solução e devem ser chamadas de soluto. Por outro lado, partículas com diâmetro superior a 1000 nm estariam dispersas em misturas denominadas suspensões. Os cientistas observaram que partículas com diâmetro entre 1,0 nm e 1000 nm participam de um campo muito importante, chamado de misturas coloidais ou simplesmente colóides.
Analisando o quadro a seguir, podemos comparar características gerais das soluções, das misturas coloidais e das suspensões. Note que, nas misturas em geral, a substância em menor quantidade pode ser chamada de disperso, ou seja, é uma substância que se encontra espalhada, de maneira homogênea ou não, em outra substância denominada dispersante. Nessas condições, a mistura receberá o nome geral de dispersão.
|
|
SOLUÇÃO
|
DISPERSÃO COLOIDAL
|
SUSPENSÃO
|
| DISPERSO |
ÁTOMOS, ÍONS,
MOLÉCULAS
|
AGLOMERADOS
|
GRANDES
AGLOMERADOS
|
|
DIÂMETRO (d)
|
d < 1nm
|
1nm < d < 1000nm
|
d >
1000nm
|
|
VISIBILIDADE
|
NÃO SÃO
VISÍVEIS
|
VISÍVEL NO ULTRAMICROSCÓPIO
|
VISÍVEL A OLHO
NU
|
|
DECANTAÇÃO
|
NÃO
DECANTA
|
DECANTA NO
ULTRACENTRIFUGADOR
|
DECANTAÇÃO
ESPONTÂNEA
|
|
AÇÃO DO FILTRO
|
NÃO SEPARA
|
SEPARA NO
ULTRAFILTRO
|
SEPARA NO FILTRO
COMUM
|
|
EXEMPLOS
|
SAL EM
ÁGUA
|
GELATINA EM
ÁGUA
|
ÁGUA
BARRENTA
|
Lembrando que:
1
Å (angström) = 10 –7 mm = 10 - 8 cm = 10 -
9 nm = 10 - 10 m
O ESTADO COLOIDAL
OS PRINCIPAIS TIPOS DE DISPERSÕES COLOIDAIS
Como você perceberá , as dispersões coloidais possuem participações importantes em nosso cotidiano, sendo classificadas de acordo com o estado físico dos participantes. Vários alimentos, medicamentos e produtos cosméticos são sistemas coloidais. Veja alguns exemplos no quadro abaixo:
SAIBA MAIS SOBRE.....
UMA RECEITA DE GELATINA
: COLÓIDES SOL E GEL
 A receita que acompanha a
embalagem de uma gelatina em pó descreve o seguinte método de
preparação:
A receita que acompanha a
embalagem de uma gelatina em pó descreve o seguinte método de
preparação:
- Despeje o conteúdo da embalagem em um recipiente.
- Adicione uma xícara (250 mL) de água fervente.
- Mexa até dissolver completamente.
- Adicione mais uma xícara de água fria ou gelada.
- Coloque o recipiente na geladeira.
Do ponto de vista químico, a gelatina em pó é uma mistura de moléculas enormes, de grande massa molecular, denominadas proteínas. E estas, por sua vez, são resultantes da união de moléculas menores, denominadas aminoácidos.A hemoglobina, por exemplo, que transporta oxigênio no sangue, possui cerca de 9 nm de diâmetro e massa molecular igual a 64 500 u.
Como as moléculas de proteína apresentam um diâmetro situado entre 1,0 nm e 1000 nm, dizemos que possuem dimensões coloidais. Assim, o pó de gelatina, quando misturado em água aquecida, constitui um colóide sol.
No entanto, o esfriamento final da gelatina na geladeira faz com que as fibras de proteínas formem uma malha e passem a constituir o que chamamos de colóide gel.
No gel, a fase dispersante forma uma complexa grade tridimensional que mantém o disperso em uma estrutura semi-rígida. Em alguns tipos de gel, essa estrutura pode ser rompida por agitação. É o que ocorre, por exemplo, com algumas tintas. Por agitação com o pincel, o gel transforma-se em sol. Na parede, com o repouso, o gel volta a se reconstituir.
 A receita que acompanha a
embalagem de uma gelatina em pó descreve o seguinte método de
preparação:
A receita que acompanha a
embalagem de uma gelatina em pó descreve o seguinte método de
preparação:- Despeje o conteúdo da embalagem em um recipiente.
- Adicione uma xícara (250 mL) de água fervente.
- Mexa até dissolver completamente.
- Adicione mais uma xícara de água fria ou gelada.
- Coloque o recipiente na geladeira.
Do ponto de vista químico, a gelatina em pó é uma mistura de moléculas enormes, de grande massa molecular, denominadas proteínas. E estas, por sua vez, são resultantes da união de moléculas menores, denominadas aminoácidos.A hemoglobina, por exemplo, que transporta oxigênio no sangue, possui cerca de 9 nm de diâmetro e massa molecular igual a 64 500 u.
Como as moléculas de proteína apresentam um diâmetro situado entre 1,0 nm e 1000 nm, dizemos que possuem dimensões coloidais. Assim, o pó de gelatina, quando misturado em água aquecida, constitui um colóide sol.
No entanto, o esfriamento final da gelatina na geladeira faz com que as fibras de proteínas formem uma malha e passem a constituir o que chamamos de colóide gel.
No gel, a fase dispersante forma uma complexa grade tridimensional que mantém o disperso em uma estrutura semi-rígida. Em alguns tipos de gel, essa estrutura pode ser rompida por agitação. É o que ocorre, por exemplo, com algumas tintas. Por agitação com o pincel, o gel transforma-se em sol. Na parede, com o repouso, o gel volta a se reconstituir.
DE ONDE VEM A
GELATINA? A proteína mais abundante
dos vertebrados é o colágeno, que constitui aproximadamente 25% em massa das
proteínas do corpo humano. Parte dos ossos, tendões, dentes e pele é constituída
de colágeno.
A proteína mais abundante
dos vertebrados é o colágeno, que constitui aproximadamente 25% em massa das
proteínas do corpo humano. Parte dos ossos, tendões, dentes e pele é constituída
de colágeno.
Apesar de o colágeno não ser comestível, seu aquecimento em água fervente produz uma mistura de outras proteínas comestíveis, denominadas genericamente de gelatinas. Tais proteínas são usadas na fabricação de vários produtos, tais como filmes fotográficos, colas, cápsulas de medicamentos e produtos alimentícios.
As proteínas pertencem à classe dos colóides liófilos, ou seja, aqueles que possuem afinidade com água. Como esses colóides têm maior facilidade em transformar-se do estado gel para sol, ou vice-versa, são chamados de reversíveis.
 A proteína mais abundante
dos vertebrados é o colágeno, que constitui aproximadamente 25% em massa das
proteínas do corpo humano. Parte dos ossos, tendões, dentes e pele é constituída
de colágeno.
A proteína mais abundante
dos vertebrados é o colágeno, que constitui aproximadamente 25% em massa das
proteínas do corpo humano. Parte dos ossos, tendões, dentes e pele é constituída
de colágeno.Apesar de o colágeno não ser comestível, seu aquecimento em água fervente produz uma mistura de outras proteínas comestíveis, denominadas genericamente de gelatinas. Tais proteínas são usadas na fabricação de vários produtos, tais como filmes fotográficos, colas, cápsulas de medicamentos e produtos alimentícios.
As proteínas pertencem à classe dos colóides liófilos, ou seja, aqueles que possuem afinidade com água. Como esses colóides têm maior facilidade em transformar-se do estado gel para sol, ou vice-versa, são chamados de reversíveis.
O CITOPLASMA: COLÓIDE
OU SOLUÇÃO?
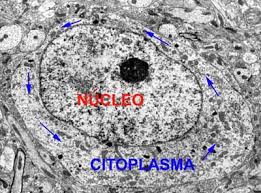 Você provavelmente se
lembra de que os orgânulos do citoplasma estão mergulhados num material amorfo,
viscoso, chamado hialoplasma. Como componente majoritário, o hialoplasma contém,
antes de mais nada, muita água. Em segundo lugar, em termos de quantidade,
encontramos moléculas de proteínas.
Você provavelmente se
lembra de que os orgânulos do citoplasma estão mergulhados num material amorfo,
viscoso, chamado hialoplasma. Como componente majoritário, o hialoplasma contém,
antes de mais nada, muita água. Em segundo lugar, em termos de quantidade,
encontramos moléculas de proteínas.
Neste sentido, podemos classificar o hialoplasma como sendo um colóide, devido ao tamanho das macromoléculas protéicas. Por outro lado, dissolvidas na água do hialoplasma, há uma grande variedade de substâncias, com partículas de diâmetro inferior a 1 nm: sais minerais, gases da respiração, açúcares, aminoácidos, ácidos graxos, nucleotídeos, etc. Se o critério de classificação forem essas moléculas, você poderia dizer, sem dúvida, que o hialoplasma é uma solução. Se você estiver considerando o plasma, parte líquida do sangue, a situação é parecida: muita água como dispersante, moléculas de proteínas, principalmente albumina, sais minerais, açúcares, ácidos graxos, vitaminas, gases respiratórios. Dessa forma, o plasma sangüíneo é um colóide e, ao mesmo tempo, uma solução.
 Você provavelmente se
lembra de que os orgânulos do citoplasma estão mergulhados num material amorfo,
viscoso, chamado hialoplasma. Como componente majoritário, o hialoplasma contém,
antes de mais nada, muita água. Em segundo lugar, em termos de quantidade,
encontramos moléculas de proteínas.
Você provavelmente se
lembra de que os orgânulos do citoplasma estão mergulhados num material amorfo,
viscoso, chamado hialoplasma. Como componente majoritário, o hialoplasma contém,
antes de mais nada, muita água. Em segundo lugar, em termos de quantidade,
encontramos moléculas de proteínas. Neste sentido, podemos classificar o hialoplasma como sendo um colóide, devido ao tamanho das macromoléculas protéicas. Por outro lado, dissolvidas na água do hialoplasma, há uma grande variedade de substâncias, com partículas de diâmetro inferior a 1 nm: sais minerais, gases da respiração, açúcares, aminoácidos, ácidos graxos, nucleotídeos, etc. Se o critério de classificação forem essas moléculas, você poderia dizer, sem dúvida, que o hialoplasma é uma solução. Se você estiver considerando o plasma, parte líquida do sangue, a situação é parecida: muita água como dispersante, moléculas de proteínas, principalmente albumina, sais minerais, açúcares, ácidos graxos, vitaminas, gases respiratórios. Dessa forma, o plasma sangüíneo é um colóide e, ao mesmo tempo, uma solução.
OS COLÓIDES E O MOVIMENTO AMEBÓIDE
Não se sabe ainda, ao certo, os mecanismos que levam o hialoplasma da ameba a se transformar e fluir para formar os pseudópodes. Há fortes indícios, no entanto, de que finíssimos filamentos de uma proteína chamada actina, presentes no hialoplasma estejam relacionados com esse fluxo citoplasmático, fundamental para a formação de pseudópodes. Uma observação: a actina de que estamos falando é a mesma substância que, em conjunto com a miosina, forma o complexo contrátil das células musculares.
AS EMULSÕES: COMO SE FAZ MAIONESE?
 Todos sabemos que água e
óleo não se misturam e isso habitualmente é justificado pelo fato da água ser um
líquido polar, enquanto o óleo é formado por moléculas praticamente
apolares.
Todos sabemos que água e
óleo não se misturam e isso habitualmente é justificado pelo fato da água ser um
líquido polar, enquanto o óleo é formado por moléculas praticamente
apolares.Se você agitar uma mistura de água e óleo em um liquidificador, gotas de óleo, de dimensões coloidais, ficarão espalhadas na água por algum tempo. A esse sistema chamamos de emulsão.
Note que, após alguns minutos, as gotas de óleo aglutinam-se e a fase oleosa é reconstituída, voltando a flutuar sobre a água. Isto significa que a emulsão formada era instável.
Você sabe como se faz maionese?
 Para fazer maionese, basta
colocar uma gema do ovo em um liquidificador, bater vigorosamente e acrescentar
um pouco de óleo. Forma-se, assim, uma emulsão estável.
Para fazer maionese, basta
colocar uma gema do ovo em um liquidificador, bater vigorosamente e acrescentar
um pouco de óleo. Forma-se, assim, uma emulsão estável.Mas como isso acontece? Como o óleo e a água podem ser misturados?
A razão fundamental está na presença das proteínas da gema.
As moléculas de proteína envolvem as gotas de óleo, formando uma película hidrófila, ou seja, que possui afinidade com a água. A essas proteínas chamamos de colóides protetores ou agentes emulsificantes ou tensoativos.
(Obs.: Muitas vezes, o mesmo sistema se enquadra em várias classificações. O leite, por exemplo, é uma solução aquosa de sais e açúcares; um colóide sol em relação às proteínas e uma emulsão em relação às gorduras. No leite, o agente emulsificante é uma proteína chamada caseína. Além disso, algumas partículas de gordura, grandes o suficiente para serem vistas ao microscópio comum, estão em suspensão.)
O QUE SÃO TENSOATIVOS
Os tensoativos são responsáveis pela característica mais importante e desejada em um detergente, a capacidade de remoção das sujidades e também de permitir a miscibilidade de um óleo na água. Este fato é possível devido a sua estrutura, que possui uma parte hidrofílica e uma parte hidrofóbica.
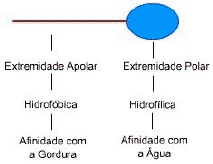 A figura ao
lado representa esquematicamente a estrutura de um tensoativo. Eles reduzem a
tensão superficial da água, permitindo que a sujeira possa ser removida
facilmente ou mesmo que um óleo possa se misturar com a água, através da
formação de micelas.
A figura ao
lado representa esquematicamente a estrutura de um tensoativo. Eles reduzem a
tensão superficial da água, permitindo que a sujeira possa ser removida
facilmente ou mesmo que um óleo possa se misturar com a água, através da
formação de micelas.Numa micela, a extremidade apolar do tensoativo fica voltada para o centro, interagindo com o óleo (ou substâncias hidrofóbicas) enquanto a extremidade polar para fora (interagindo com a água).
As micelas são estruturas geralmente esféricas, de natureza coloidal, formadas de tal modo que as partes não polares do detergente se orientam para o interior da mesma, criando assim, uma superfície iônica. Podemos dizer que as soluções de tensoativos formam sistemas dinâmicos onde as micelas estão continuamente sendo formadas e destruídas. Essa característica das soluções de detergentes é importante para o processo de
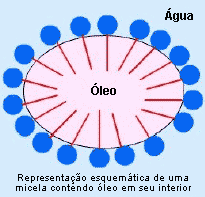 remoção das sujidades, que envolve o
deslocamento das partículas de sujeiras de natureza lipofílica para o interior
das micelas e a estabilização das mesmas de modo a mantê-las em suspensão,
evitando que a sujeira volte a depositar-se sobre a superfície que está sendo
limpa.
remoção das sujidades, que envolve o
deslocamento das partículas de sujeiras de natureza lipofílica para o interior
das micelas e a estabilização das mesmas de modo a mantê-las em suspensão,
evitando que a sujeira volte a depositar-se sobre a superfície que está sendo
limpa.Os tensoativos são divididos em aniônicos, catiônicos, anfóteros e não iônicos.
A associação de alguns deles pode, além de outras coisas, melhorar o poder de limpeza do detergente e diminuir sua irritabilidade, ou seja, aumentar sua suavidade.
Exemplos: Lauril, proteínas, etc.
De um modo geral, na grande maioria dos casos, podemos dizer que um tensoativo apresenta ao mesmo tempo características de agente molhante, de agente emulsionante, de detergente e de espumante. Entretanto, uma destas características é sempre mais marcante em um determinado tensoativo do que as demais. É esta característica dominante que determina a sua classificação como detergente, emulsionante, etc., conforme o caso.
O EFEITO TYNDALL
Se colocarmos lado a lado um copo com solução aquosa de açúcar e outro copo com leite diluído em água, o feixe de uma caneta laser deixará um rastro somente no copo que contém uma dispersão coloidal de gelatina em água.
Este fenômeno, conhecido como efeito Tyndall, ocorre devido à dispersão da luz pelas partículas coloidais. No béquer contendo uma solução de açúcar em água, as moléculas do soluto não são suficientemente grandes para dispersarem a luz.

Efeito de
Tyndall: Os colóides dispersam fortemente a luz, pois
as partículas dispersas têm tamanhos semelhantes ao comprimento de onda da luz
visível. Este fenômeno é chamado efeito de
Tyndall e permite distinguir as soluções verdadeiras dos colóides, pois
as soluções verdadeiras são transparentes, ou seja não dispersam a
luz
O efeito Tyndall recebeu esse nome , em homenagem
ao brilhante físico inglês, John Tyndall (1820 – 1893), que demonstrou por que o
céu é azul, e estudou de forma muito completa os fenômenos de espalhamento da
luz por partículas e poeira. Esse efeito também foi observado por Tyndall quando
um pincel de luz atravessava alguns sistemas coloidais. Esse espalhamento da luz
é seletivo, isto é, depende das dimensões das partículas dispersas e do
comprimento de onda da radiação. Dessa forma, é possível que uma determinada cor
de luz se manifeste de maneira mais acentuada do que outras.
AEROSSÓIS
 O ambiente em que
vivemos precisa ser limpo com regularidade, para que que seja retirada a poeira
que constantemente é depositada sobre os objetos.
O ambiente em que
vivemos precisa ser limpo com regularidade, para que que seja retirada a poeira
que constantemente é depositada sobre os objetos.
Esses grãos de poeira, de diâmetros superiores a 1 000 nm, estão em suspensão e tendem a sedimentar. No entanto, há no ar alguns grãos de poeira de dimensões coloidais que nunca sedimentam. Esses tipo de colóide chama-se aerossol. Neblinas , fumaças e
sprays são outros exemplos de aerossóis do cotidiano. Quando observamos o rastro
luminoso deixado pela luz de um projetor de slides em uma sala escura, ou quando
notamos os feixes luminosos dos faróis dos carros em dias com forte neblina,
devemos nos lembrar do efeito Tyndall que a luz pode provocar quando atinge
partículas coloidais sólidas existentes no ar.
Neblinas , fumaças e
sprays são outros exemplos de aerossóis do cotidiano. Quando observamos o rastro
luminoso deixado pela luz de um projetor de slides em uma sala escura, ou quando
notamos os feixes luminosos dos faróis dos carros em dias com forte neblina,
devemos nos lembrar do efeito Tyndall que a luz pode provocar quando atinge
partículas coloidais sólidas existentes no ar.
 O ambiente em que
vivemos precisa ser limpo com regularidade, para que que seja retirada a poeira
que constantemente é depositada sobre os objetos.
O ambiente em que
vivemos precisa ser limpo com regularidade, para que que seja retirada a poeira
que constantemente é depositada sobre os objetos.Esses grãos de poeira, de diâmetros superiores a 1 000 nm, estão em suspensão e tendem a sedimentar. No entanto, há no ar alguns grãos de poeira de dimensões coloidais que nunca sedimentam. Esses tipo de colóide chama-se aerossol.
 Neblinas , fumaças e
sprays são outros exemplos de aerossóis do cotidiano. Quando observamos o rastro
luminoso deixado pela luz de um projetor de slides em uma sala escura, ou quando
notamos os feixes luminosos dos faróis dos carros em dias com forte neblina,
devemos nos lembrar do efeito Tyndall que a luz pode provocar quando atinge
partículas coloidais sólidas existentes no ar.
Neblinas , fumaças e
sprays são outros exemplos de aerossóis do cotidiano. Quando observamos o rastro
luminoso deixado pela luz de um projetor de slides em uma sala escura, ou quando
notamos os feixes luminosos dos faróis dos carros em dias com forte neblina,
devemos nos lembrar do efeito Tyndall que a luz pode provocar quando atinge
partículas coloidais sólidas existentes no ar.
ESPUMAS
 Quando um gás é
borbulhado em um líquido, além das bolhas enormes e visíveis, são formadas
também bolhas de dimensões coloidais. Por isso, as espumas também podem ser
classificadas como colóides. Um bom exemplo é o chantilly, formado pela mistura
de ar em creme de leite. Um sólido que possui poros de dimensões coloidais é
classificado como espuma sólida. É o caso, por exemplo, da pedra-pome, que
possui ar em microscópicos poros de dimensões coloidais.
Quando um gás é
borbulhado em um líquido, além das bolhas enormes e visíveis, são formadas
também bolhas de dimensões coloidais. Por isso, as espumas também podem ser
classificadas como colóides. Um bom exemplo é o chantilly, formado pela mistura
de ar em creme de leite. Um sólido que possui poros de dimensões coloidais é
classificado como espuma sólida. É o caso, por exemplo, da pedra-pome, que
possui ar em microscópicos poros de dimensões coloidais.
Como você percebeu através destas rápidas informações, o vasto campo dos sistemas coloidais é atraente e gerador de muitas atividades profissionais. No mundo, as industrias ligadas aos colóides empregam milhões de pessoas e movimentam muitos bilhões de dólares.
Para ler mais:
Biologia, de Sezar Sasson e César S.Júnior (Ed. Saraiva)
Química- Realidade e Contexto, de A. Lembo (Ed. Ática)
Fundamentos de Química Geral, de Morris Hein e Susan Arena (Ed.Livros Técnicos e Científicos)
 Quando um gás é
borbulhado em um líquido, além das bolhas enormes e visíveis, são formadas
também bolhas de dimensões coloidais. Por isso, as espumas também podem ser
classificadas como colóides. Um bom exemplo é o chantilly, formado pela mistura
de ar em creme de leite. Um sólido que possui poros de dimensões coloidais é
classificado como espuma sólida. É o caso, por exemplo, da pedra-pome, que
possui ar em microscópicos poros de dimensões coloidais.
Quando um gás é
borbulhado em um líquido, além das bolhas enormes e visíveis, são formadas
também bolhas de dimensões coloidais. Por isso, as espumas também podem ser
classificadas como colóides. Um bom exemplo é o chantilly, formado pela mistura
de ar em creme de leite. Um sólido que possui poros de dimensões coloidais é
classificado como espuma sólida. É o caso, por exemplo, da pedra-pome, que
possui ar em microscópicos poros de dimensões coloidais.Como você percebeu através destas rápidas informações, o vasto campo dos sistemas coloidais é atraente e gerador de muitas atividades profissionais. No mundo, as industrias ligadas aos colóides empregam milhões de pessoas e movimentam muitos bilhões de dólares.
Para ler mais:
Biologia, de Sezar Sasson e César S.Júnior (Ed. Saraiva)
Química- Realidade e Contexto, de A. Lembo (Ed. Ática)
Fundamentos de Química Geral, de Morris Hein e Susan Arena (Ed.Livros Técnicos e Científicos)
SOLUÇÕES
São misturas homogêneas de duas ou mais substâncias.
Nas soluções a fase dispersa recebe o nome de soluto e o dispersante de solvente.
Existem vários tipos de solventes, porém, só iremos considerar soluções nas quais o solvente é a água (solvente universal), denominadas de soluções aquosas.
CLASSIFICAÇÃO DAS SOLUÇÕES
DE ACORDO COM O ESTADO FÍSICO
SOLUÇÃO SÓLIDA
O solvente é sempre sólido e o soluto pode ser: sólido, líquido ou gasoso.

Estátua em Bronze do século V a.C.: solução sólida (liga metálica de
cobre e estanho)
Exemplos: ligas
metálicas (Solda: Sn+Pb, Ouro 18K: Au+Ag e/ou Cu, Bronze: Cu+Sn, Aço: Fe+C,
Latão: Cu+Zn, Amálgama: Hg+Ag, etc.)SOLUÇÃO LÍQUIDA
O solvente é sempre líquido e o soluto pode ser: sólido, líquido ou gasoso.

Refrigerante: solução líquida com solvente líquido e soluto
gasoso
Exemplos: soro
fisiológico (água - solvente, sal - soluto), refrigerantes (água - solvente, gás
carbônico - soluto), álcool hidratado (água - solvente, álcool -
soluto)SOLUÇÃO GASOSA
O solvente é gasoso e o soluto gasoso.

Gás
de cozinha: solução gasosa com mistura de gases propano e butano.
Exemplo: ar atmosférico
filtradoDE ACORDO COM A NATUREZA DO SOLUTO
SOLUÇÃO MOLECULAR
As partículas dispersas do soluto são moléculas. A solução molecular é também chamada de solução não-eletrolítica.
Exemplo: água + açúcar (C6H12O6).
SOLUÇÃO IÔNICA
As partículas dispersas do soluto são íons ou íons e moléculas (dependendo do sal ou do ácido).
Exemplo: água + sal (NaCl), água + ácido clorídrico (HCl)
Esquematicamente temos:
DE ACORDO COM A PROPORÇÃO DO SOLUTO EM RELAÇÃO AO SOLVENTE
Num determinado dia, ao receber visitas em sua casa, você resolve preparar suco de laranja e suco de uva para servir a seus convidados. Ao servir o suco de laranja, nota-se que algumas pessoas fazem cara feia e dizem: nossa como está forte! Enquanto que outras pessoas que beberam suco de uva dizem: Hum, este está muito fraco!
Nestes dois casos descritos acima, podemos observar que temos dois tipos de soluções: diluída e concentrada.
DILUÍDA
Pouco soluto dissolvido em relação ao solvente (suco de uva).
CONCENTRADA
Muito soluto dissolvido em relação ao solvente (suco de laranja).
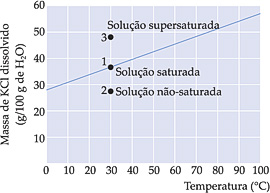
Ao juntarmos, gradativamente, açúcar e água em temperatura constante e sob agitação contínua, notamos que o sólido se dissolve, até não poder ser mais visto. Vamos acrescentando mais açúcar e tornando a solução mais concentrada, até que em um dado momento, o açúcar não se dissolve mais na água, mas se deposita no fundo ou se precipita ou se deposita ou se decanta. Neste momento, dizemos que a solução está saturada e apresenta um corpo de fundo.
SATURADA
Solução que contém uma quantidade máxima de soluto dissolvido no solvente numa determinada temperatura e pressão.
Esta quantidade máxima de soluto dissolvido é expresso através do coeficiente de solubilidade (CS).
Por exemplo, a 20 °C, a solubilidade do KNO3 é 31,6 g em cada 100 g de H2O. Isto significa que podemos dissolver até 31,6 g de KNO3 a 20 °C em 100 g de H2O.
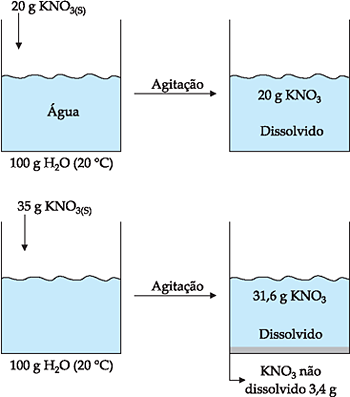
INSATURADA OU NÃO SATURADA
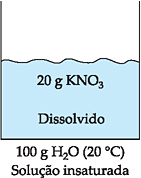
Ocorre quando a quantidade de soluto adicionada é inferior ao coeficiente de solubilidade. Por exemplo, o coeficiente de solubilidade do KNO3 em água a 20 °C é 31,6 g/100 g H2O, portanto, a adição de qualquer quantidade de KNO3 abaixo de 31,6 g em 100 g de água, a 20 °C, produz solução insaturada
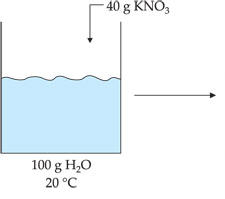
Solução que contém uma quantidade de soluto dissolvido superior à solução saturada por meio de uma variação de temperatura.
Por exemplo: a 40 °C, a solubilidade do KNO3 é 61,47 g/100 g H2O e, a 20 °C, é 31,6 g/100 g H2O.
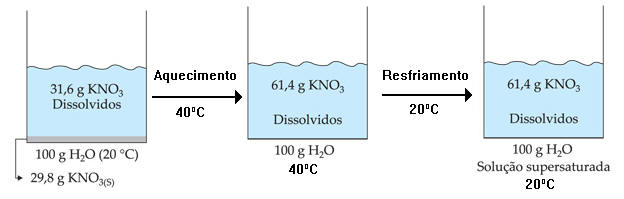
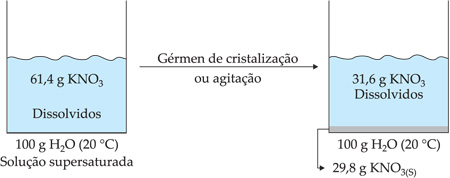
Resumindo temos:
Solubilidade de Gases em Líquidos
Normalmente, os gases são pouco solúveis nos líquidos. Dois fatores alteram consideravelmente a solubilidade:
Temperatura
 Todo aumento de temperatura diminui a
solubilidade do gás no líquido – Por exemplo, para eliminar gases dissolvidos na
água, é feito o aquecimento por um certo período de tempo. Sendo assim, a
diminuição da temperatura facilita a solubilidade de um gás num líquido - Por
exemplo, na piracema os peixes nadam contra a corrente para realizar a desova
nas nascentes onde as águas são mais oxigenadas, portanto, facilitando a
reprodução e desova.
Todo aumento de temperatura diminui a
solubilidade do gás no líquido – Por exemplo, para eliminar gases dissolvidos na
água, é feito o aquecimento por um certo período de tempo. Sendo assim, a
diminuição da temperatura facilita a solubilidade de um gás num líquido - Por
exemplo, na piracema os peixes nadam contra a corrente para realizar a desova
nas nascentes onde as águas são mais oxigenadas, portanto, facilitando a
reprodução e desova.Pressão
Quando não ocorre reação do gás com o líquido, a influência da pressão é estabelecida pela lei de Henry:
"Em temperatura constante, a solubilidade de um gás num líquido é diretamente proporcional à pressão".

Curvas de Solubilidade
São diagramas que mostram a variação dos coeficientes de solubilidade das substâncias em função da temperatura.
O gráfico abaixo representa a solubilidade de várias substâncias em função da temperatura.
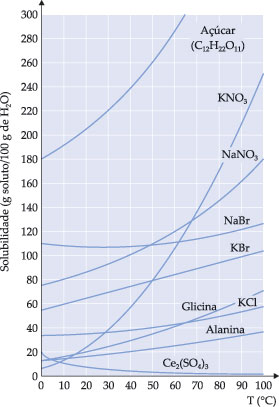
Para uma substância como Ce2(SO4)3, a solubilidade diminui com o aumento da temperatura; portanto, trata-se de uma dissolução exotérmica.
O gráfico do coeficiente de solubilidade em função da temperatura é utilizado principalmente para informar a solubilidade de uma ou várias substâncias em função da temperatura. Por exemplo:
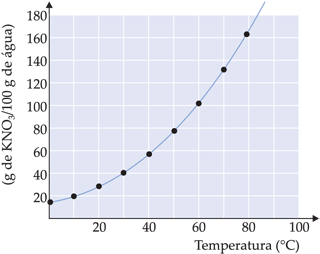
– na temperatura de 50°C, a quantidade máxima de KNO3 que se dissolve em 100 g de água são 80 g. A solução em questão é saturada;
– para obtermos uma solução saturada KNO3 a 40°C, basta dissolver 60 g de KNO3 em 100 g de água;
– se resfriarmos uma solução saturada de 50°C para 40°C, teremos um corpo de fundo igual a 20 g de KNO3;
– 200 g de água a 40°C dissolvem no máximo 120 g de KNO3.
PREPARANDO UMA SOLUÇÃO
Materiais utilizados no preparo da solução.
Para prepararmos uma solução de 80 g de NaOH em 1 litro de
solução, seguiremos o seguinte roteiro:1) Medir a massa do soluto (80 g de NaOH);








IDENTIFICANDO A SOLUÇÃO
Depois de preparar a solução devemos transferir a solução para o frasco, previamente rotulado com uma etiqueta, indicando o nome da solução, a sua concentração e a data de preparação.
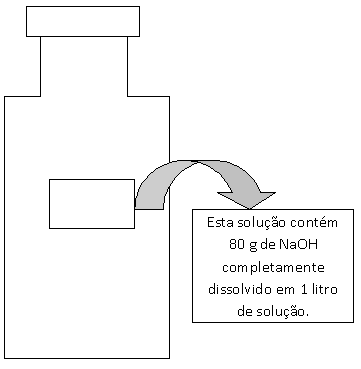
Mas observe que as informações referentes à solução
não cabem no rótulo, portanto, neste caso devemos codificar as
informações através de relações matemáticas simplificadas denominadas de
concentrações das soluções.
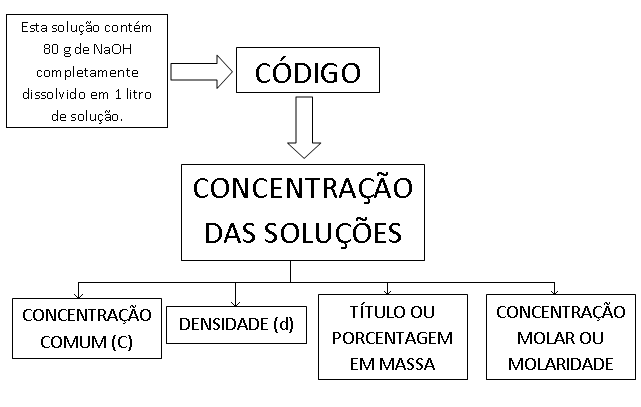
Indica a relação da massa do soluto em gramas pelo volume da solução em litros.
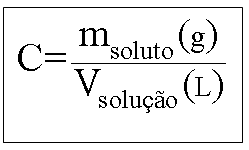
Esta solução contém 80 g de NaOH dissolvido em qsp (quantidade suficiente para) 1 litro de solução.
Densidade (d)
Indica a relação da massa da solução pelo volume por ela ocupado.
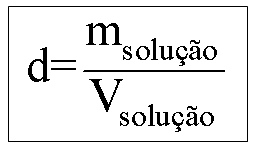
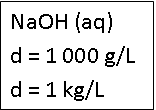
Cada 1 litro da solução de NaOH possui massa de 1000 g ou 1 kg.
Observação
Não confunda Concentração Comum (C) e densidade (d).
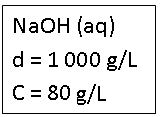
Soluto: NaOH = 80 g
Solvente: H2O = 920 g
Solução: NaOH (aq) = 1000 g
Interpretação
d = 1000 g/L → cada 1 litro da solução de NaOH possui massa de 1000 g.
C = 80 g/L → cada 1 litro de solução possui 80 g de NaOH dissolvido.
Concentração Molar ou Molaridade
Indica a relação do número de mols do soluto, pelo volume da solução em litros.
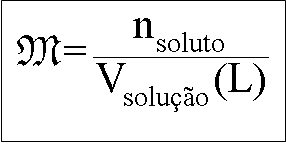
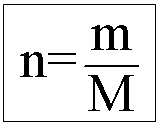
Onde: n = número de mols, m = massa em gramas, M = massa molar (g/mol)
No exemplo ilustrado acima, codificando as informações da solução teríamos:
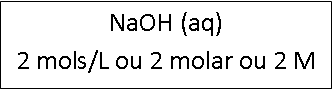
Cada 1 litro da solução possui 2 mols de NaOH dissolvido. (Dado: NaOH - M = 40g/mol)
Concentração Molar para Soluções Iônicas
Monta-se a equação da dissociação do eletrólito (soluto) e, em seguida, verifica-se a quantidade em mols do cátion e do ânion produzidos para cada mol do soluto. Assim, teremos uma relação em mol/L entre o soluto e os íons produzidos. Observe os exemplos a seguir:
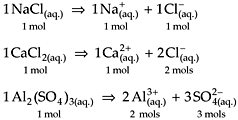
PORCENTAGEM EM MASSA OU TÍTULO
Indica a relação da massa do soluto pela massa da solução, ou ainda, a porcentagem em massa do soluto na massa da solução.

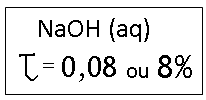
Da massa total da solução 8% corresponde à massa do soluto.
Exemplos

No
rótulo de um frasco de soro fisiológico à 0,9 % interpretamos da seguinte
maneira: em 100 mL do soro fisiológico temos 0,9 g de NaCl.


Vodka 40% volume ou 40oGL: 100 mL da bebida possui 40% em
volume ou 40 mL de álcool etílico

Cerveja 5,2% volume ou 5,2oGL: 100 mL da bebida possui 5,2%
em volume ou 5,2 mL de álcool etílico
A água
oxigenada 10 vol ou 20 vol é uma solução aquosa que à temperatura ambiente sofre
decomposição:
H2O2(aq) → H2O(l) +
O2(g)
Devido a liberação do oxigênio, esta solução é utilizada
como antisséptico na limpeza de ferimentos, pois o oxigênio liberado elimina as
bactérias aeróbicas, que causam o apodrecimento do tecido.
Água
oxigenada é utilizado como antisséptico na limpeza de feridas.

Água
oxigenada 10 volumes utilizado para desinfecção de ferimentos: 1 cm3
H2O2(aq) produz 10 cm3 de O2(g) nas
CNTP

Água
oxigenada 20 volumes utilizado para descolorir cabelos: 1 cm3
H2O2(aq) produz 20 cm3 de O2(g) nas
CNTP
Saiba mais sobre....
|
Graduação
alcoólica
A graduação é o volume de álcool
existente por litro de bebida, apresentada em percentagem (%). Esta exprime-se
em graus e varia de bebida para bebida.
Por exemplo:
1 litro de vinho de 12º tem 12%,
0,12 L ou 120 mL de álcool.
1 litro de cerveja a 6º tem 6%, 0,06 L ou 60 mL de álcool. 1 litro de aguardente de 50º tem 50%, 0,5 L ou 500 mL de álcool.
Para sabermos quantas gramas de
álcool existem por litro de sangue, taxa de alcoolemia e o seu cálculo, temos de
calcular a quantidade de álcool em gramas. Como a graduação de uma bebida é uma
relação entre volumes, temos de transformar o volume de álcool em
massa.
A medida
física que nos permite fazer esta relação é a densidade, sendo a densidade do
álcool de 0,8 g/mL. Para acharmos a massa em gramas (g), multiplicamos o volume
pela sua densidade.
Por exemplo:
0,2 L de vinho de 12º
→ 24 mL de álcool x 0,8 g/mL = 19,2 g
0,5 L de cerveja de 6º → 30 mL de álcool x 0,8 g/mL = 24 g
As bebidas mais graduadas
são
servidas em copos menores
As bebidas menos graduadas em copos maiores (como a cerveja)
Tipos de bebidas alcoólicas e sua
graduação
| |
|
Tipo
de bebida
Cerveja Vinho Champanhe Vodka Rum, Gin Aguardente Whisky Absinto |
Intervalo de Graduação
4º a 9º 11º a 14º 12º a 16º 30º a 40º 40º a 45º 40º a 48º 40º a 50º 50º a 54º |
|
Pode beber-se a mesma quantidade
de álcool ingerindo bebidas diferentes.
Por exemplo:
0,25 L de Champanhe (12º)
→ 30 mL x 0,8 g/mL = 24 g
0,075 L de Whisky (40º) → 30 mL x 0,8 g/mL = 24 g
Os shots (bebidas servidas em
copos pequenos e bebidos de uma só vez) correspondem a uma mistura explosiva de
várias bebidas com uma alta graduação.
Taxa de alcoolemia e o seu
cálculo
A taxa de alcoolemia é a
quantidade de álcool existente nos sangue de um indivíduo, em determinado
momento, e expressa-se em gramas de álcool por litro de sangue (g/L). Assim,
quando se fala de uma alcoolemia de 0,5 g/L é o mesmo que dizer que existem 0,5
g de álcool por litro de sangue.
Esta taxa é facilmente atingida após a ingestão de 3 copos de vinho ou 0,5 L de cerveja e depende de vários fatores: · Tipo e quantidade de bebida ingerida · Momento da absorção (jejum/às refeições/fora das refeições) · Ritmo de ingestão · Peso e sexo do indivíduo · Estado de saúde e estado de fadiga A alcoolemia aumenta à medida que o etanol é absorvido pelo organismo e diminui lentamente de acordo com a degradação do álcool pelo fígado. | |
CÓDIGO NACIONAL DE TRÂNSITO
Em 19 de junho de 2008 foi aprovada a Lei 11.705, modificando o Código de Trânsito Brasileiro. Apelidada de "lei seca", proíbe o consumo da quantidade de bebida alcoólica superior a 0,1 mg de álcool por litro de ar expelido dos pulmões no exame do bafômetro (ou 2 dg de álcool por litro de sangue) por condutores de veículos, ficando o condutor transgressor sujeito a pena de multa, a suspensão da carteira de habilitação por 12 meses e até a pena de detenção, dependendo da concentração de álcool por litro de sangue.
Apesar de não ser permitida nenhuma concentração de álcool, existem valores fixos, prevendo casos excepcionais, tais como medicamentos à base de álcool e erro do aparelho que faz o teste. A concentração permitida no Brasil é de 0,2 g de álcool por litro de sangue, ou, 0,1 mg de álcool por litro de ar expelido dos pulmões no exame do bafômetro.
Essa equivalência (sangue e ar) é em decorrência da Lei de Henry, acerca das trocas entre um gás, um vapor (álcool) e um líquido (sangue), sendo que existe uma relação constante entre a quantidade de álcool existente no sangue e no ar alveolar, sendo essa constante de 1/2000. Assim, 1 cm3 de sangue contém tanto álcool quanto 2000 cm3 de ar alveolar.
O entendimento dessa relação de equivalência é de suma importância, especialmente considerando-se que uma das formas que nossas autoridades utilizam para comprovar a infração é por meio do "bafômetro". Deve o agente da autoridade de trânsito tomar cautela em saber qual a unidade que o resultado do exame o está informando. Nos bafômetros o resultado obtido é em %BAC (Blood Alcohol Concentrations) , que é numericamente o mesmo que a quantidade do álcool no sangue e não no ar alveolar.
Para exemplificar melhor, o resultado no bafômetro de 0,08 BAC significa 8 decigramas por litro de sangue ou 0,4 mg por litro de ar alveolar, ou ainda, 1mL por litro de sangue, pela densidade do álcool ser um pouco inferior ao da água (1mL de água = 1g de água). Em recente reportagem do Jornal Folha de São Paulo foi relatado o caso de uma jovem estudante detida e encaminhada para a delegacia de polícia pela condução de veículo sob influência de álcool. Mais tarde comprovou-se que na verdade ela estava exatamente na metade do limite estabelecido pelo CTB. Quem sabe o erro cometido pelo agente policial não reside no desconhecimento de tais equivalências?
Metabolismo do álcool
O metabolismo no fígado remove de 90% a 98% da droga circulante. O resto é eliminado pelos rins, pulmões e pele.
Um adulto de 70kg consegue metabolizar de 5 a 10 gramas de álcool por hora. Como um drinque contém, em média, de 12 a 15 gramas, a droga acumula-se progressivamente no organismo, mesmo em quem bebe apenas um drinque por hora.
O álcool que cai na circulação sofre um processo químico chamado oxidação que o decompõe em gás carbônico (CO2) e água. Como nesse processo ocorre liberação de energia, os médicos recomendam evitar bebidas alcoólicas aos que desejam emagrecer, uma vez que cada grama de álcool ingerido produz 7,1 kcal, valor expressivo diante das 8 kcal por grama de gordura e das 4 kcal por grama de açúcar ou proteína.
Em 19 de junho de 2008 foi aprovada a Lei 11.705, modificando o Código de Trânsito Brasileiro. Apelidada de "lei seca", proíbe o consumo da quantidade de bebida alcoólica superior a 0,1 mg de álcool por litro de ar expelido dos pulmões no exame do bafômetro (ou 2 dg de álcool por litro de sangue) por condutores de veículos, ficando o condutor transgressor sujeito a pena de multa, a suspensão da carteira de habilitação por 12 meses e até a pena de detenção, dependendo da concentração de álcool por litro de sangue.
Apesar de não ser permitida nenhuma concentração de álcool, existem valores fixos, prevendo casos excepcionais, tais como medicamentos à base de álcool e erro do aparelho que faz o teste. A concentração permitida no Brasil é de 0,2 g de álcool por litro de sangue, ou, 0,1 mg de álcool por litro de ar expelido dos pulmões no exame do bafômetro.
Essa equivalência (sangue e ar) é em decorrência da Lei de Henry, acerca das trocas entre um gás, um vapor (álcool) e um líquido (sangue), sendo que existe uma relação constante entre a quantidade de álcool existente no sangue e no ar alveolar, sendo essa constante de 1/2000. Assim, 1 cm3 de sangue contém tanto álcool quanto 2000 cm3 de ar alveolar.
O entendimento dessa relação de equivalência é de suma importância, especialmente considerando-se que uma das formas que nossas autoridades utilizam para comprovar a infração é por meio do "bafômetro". Deve o agente da autoridade de trânsito tomar cautela em saber qual a unidade que o resultado do exame o está informando. Nos bafômetros o resultado obtido é em %BAC (Blood Alcohol Concentrations) , que é numericamente o mesmo que a quantidade do álcool no sangue e não no ar alveolar.
Para exemplificar melhor, o resultado no bafômetro de 0,08 BAC significa 8 decigramas por litro de sangue ou 0,4 mg por litro de ar alveolar, ou ainda, 1mL por litro de sangue, pela densidade do álcool ser um pouco inferior ao da água (1mL de água = 1g de água). Em recente reportagem do Jornal Folha de São Paulo foi relatado o caso de uma jovem estudante detida e encaminhada para a delegacia de polícia pela condução de veículo sob influência de álcool. Mais tarde comprovou-se que na verdade ela estava exatamente na metade do limite estabelecido pelo CTB. Quem sabe o erro cometido pelo agente policial não reside no desconhecimento de tais equivalências?
Metabolismo do álcool
O metabolismo no fígado remove de 90% a 98% da droga circulante. O resto é eliminado pelos rins, pulmões e pele.
Um adulto de 70kg consegue metabolizar de 5 a 10 gramas de álcool por hora. Como um drinque contém, em média, de 12 a 15 gramas, a droga acumula-se progressivamente no organismo, mesmo em quem bebe apenas um drinque por hora.
O álcool que cai na circulação sofre um processo químico chamado oxidação que o decompõe em gás carbônico (CO2) e água. Como nesse processo ocorre liberação de energia, os médicos recomendam evitar bebidas alcoólicas aos que desejam emagrecer, uma vez que cada grama de álcool ingerido produz 7,1 kcal, valor expressivo diante das 8 kcal por grama de gordura e das 4 kcal por grama de açúcar ou proteína.
Porque é aplicada uma injeção de glicose
(C6H12O6) em pessoas embriagadas?
O etanol ou alcool etílico, o principal componente das bebidas alcoólicas, é absorvido a partir do intestino delgado e transportado diretamente para o fígado, onde é metabolizado por reações de oxidação que interferem na síntese de glicose pela gliconeogenese ( o ciclo metabólico de conversão para glicose no organismo, que a usa como fonte de energia).
A ingestão excessiva de etanol desvia os intermediários da gliconeogenese para rotas alternativas de reação, resultando em síntese diminuída de glicose. Isso acarreta hipoglicemia (queda da taxa de açúcar no sangue). A hipoglicemia pode produzir muitos dos comportamentos associados à intoxicação alcoólica – agitação, julgamento diminuído, etc...
Em um curto período (8 a 12 horas) após a ingestão de grande quantidade de álcool pode ocorrer a ressaca, que se caracteriza por dor de cabeça, náusea, tremores e vômitos. Isso ocorre porque o metabolismo do álcool etílico gera, em uma de suas etapas, o aldeído acético que quando se acumula no organismo, é o responsável por sensações de desconforto.
A concentração de álcool no sangue depende de fatores como o volume consumido em um determinado tempo, a massa corporal, o metabolismo de quem bebe e a quantidade de comida no estomago. Quando o álcool já está no sangue, não há comida ou bebida que interfira em seus efeitos. Os sintomas que se observam são mostrados a seguir e a quantidade ingerida é diferente na mulher por conta da absorção maior e da quantidade de gordura corporal, proporcionalmente maior que no homem, o que aumenta a biodisponibilidade do álcool:
O etanol ou alcool etílico, o principal componente das bebidas alcoólicas, é absorvido a partir do intestino delgado e transportado diretamente para o fígado, onde é metabolizado por reações de oxidação que interferem na síntese de glicose pela gliconeogenese ( o ciclo metabólico de conversão para glicose no organismo, que a usa como fonte de energia).
A ingestão excessiva de etanol desvia os intermediários da gliconeogenese para rotas alternativas de reação, resultando em síntese diminuída de glicose. Isso acarreta hipoglicemia (queda da taxa de açúcar no sangue). A hipoglicemia pode produzir muitos dos comportamentos associados à intoxicação alcoólica – agitação, julgamento diminuído, etc...
Em um curto período (8 a 12 horas) após a ingestão de grande quantidade de álcool pode ocorrer a ressaca, que se caracteriza por dor de cabeça, náusea, tremores e vômitos. Isso ocorre porque o metabolismo do álcool etílico gera, em uma de suas etapas, o aldeído acético que quando se acumula no organismo, é o responsável por sensações de desconforto.
A concentração de álcool no sangue depende de fatores como o volume consumido em um determinado tempo, a massa corporal, o metabolismo de quem bebe e a quantidade de comida no estomago. Quando o álcool já está no sangue, não há comida ou bebida que interfira em seus efeitos. Os sintomas que se observam são mostrados a seguir e a quantidade ingerida é diferente na mulher por conta da absorção maior e da quantidade de gordura corporal, proporcionalmente maior que no homem, o que aumenta a biodisponibilidade do álcool:
“Se bebeu não dirija, se dirigir não beba
“
| Concentração de álcool no sangue(g/l) | Efeito |
| Até 0,16 | Nenhum efeito aparente |
| 0,200 a 0,30 | Falsa estimativa de distância e de velocidade |
| 0,30 a 0,50 | Começo de risco de acidente |
| 0,50 a 0,80 | Euforia do condutor, risco de acidente multiplicado por quatro |
| 1,50 a 3,00 | Visão dupla, condução perigosíssima |
| 3,00 a 5,00 | Embriaguez profunda, condução impossível |
| Mais que 5,00 | Coma, podendo levar a morte |
Efeitos do alcool em um individuo, em função da concentração no sangue
A resolução dos problemas, sem a utilização de fórmulas, segue as seguintes etapas:
1º) Transformar a unidade de concentração em regra de três.
Obs.: Se o problema pedir para calcular a concentração, coloca-se o padrão de volume que é sempre 1 litro.
2º) Colocar o dado e a pergunta do problema.
Obs.: Não esqueça de uniformizar as unidades.
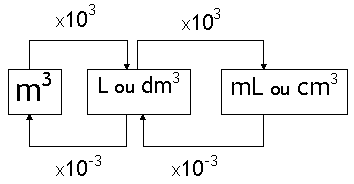
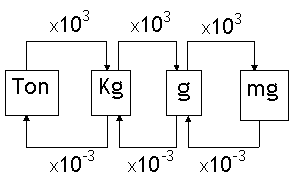
3º) Calcular o valor da incógnita.
Exemplos
01) Calcular a concentração em g/L de uma solução com 40 g de soluto em 500 cm3 de solução.
Dados:
Massa do soluto = 40 g
Volume da solução = 500 cm3 = 0,5
L
Concentração da solução = ? (g/L)
RESOLUÇÃO
40 g de soluto ------------------ 0,5 L de
solução
X ------------------ 1,0 L de
solução
X = 80 g de soluto
Desta
forma ficamos com: C = 80 g/L
02) Calcular a massa de soluto dissolvido em 250 mL de solução
com concentração de 4 g/L.
Dados:
Massa do soluto = ? (g)
Volume da solução = 250 mL = 0,25 L
Concentração da solução = 4 g/L
RESOLUÇÃO
4 g de soluto ------------------ 1,0 L de
solução
X ------------------ 0,25 L de
solução
X = 1 g de soluto
03) Um copo contém 115 mL de álcool etílico cuja densidade é 800
g/L. Qual a massa de álcool contida no copo?
Dados:
Massa álcool = ? (g)
Volume do álcool = 115 mL = 0,115 L
Densidade do álcool = 800 g/L
RESOLUÇÃO
800 g de álcool ------------------ 1,0 L de
álcool
X ------------------ 0,115 L de
álcool
X = 92 g de álcool
04) Uma solução foi preparada misturando-se 20 g de um sal em
200 mL de água (d =1 g/mL), originado uma solução cujo volume é 250 mL.
Determine a densidade da solução em g/L.
Dados:
Massa do soluto = 20 g
Volume do solvente = 200 mL
Massa do solvente = 200 g (pois a água possui d = 1
g/mL)
Com isso ficamos com: Massa da solução = 220 g (massa do
soluto + massa do solvente)
Volume da solução = 250 mL = 0,25 L
Densidade da solução = ? (g/L)
RESOLUÇÃO
220 g de solução ------------------ 0,25 L de
solução
X ------------------ 1,0 L de
solução
X = 880 g de
solução
Desta forma ficamos com: d = 880 g/L
05) Certo produto para limpar forno é uma solução aquosa 0,5 M
de NaOH. Qual a massa do NaOH contida em 800 mL do produto? (Dado: NaOH → M = 40 g/mol)
Dados:
Massa
do soluto = ? (g)
NaOH à
M = 40 g/mol
Volume
da solução = 800 mL = 0,8 L
Concentração
Molar = 0,5 M = 0,5 mol/L
RESOLUÇÃO
1º)
Determinar a massa do soluto em 1 L:
1
mol de NaOH ------------------ 40g
0,5
mol de NaOH ------------------ X
X = 20 g
2º)
Determinar a massa do soluto em 0,8 L:
20
g de NaOH ------------------- 1,0 L de solução
X ------------------- 0,8 L de solução
X = 16 g de NaOH
06) 136,8 g de
Al2(SO4)3 foram dissolvidos em água suficiente
para 800 mL de solução. Determine a concentração em mols/L da solução obtida.
(Dado: Al2(SO4)3 → M = 342 g/mol)
Dados:
Massa
do soluto = 136,8 g
Al2(SO4)3 à
M = 342 g/mol
Volume
da solução = 800 mL = 0,8 L
Concentração
Molar = ? (mol/L)
RESOLUÇÃO
1º)
Determinar o número de mols do soluto em 0,8 L de solução:
1
mol de NaOH ------------------ 342 g
X ------------------ 136,8 g
X = 0,4 mol
2º)
Determinar a concentração em mols/L:
0,4
mol de NaOH ------------------- 0,8 L de solução
X ------------------- 1,0 L de solução
X = 0,5 mol de NaOH
Desta
forma ficamos com : [NaOH] = 0,5 mol/L
07) Uma solução foi obtida dissolvendo-se 50 g de açúcar em 950
g de água. Determine a porcentagem em massa e o título desta solução.
Dados:
Massa do soluto = 50 g
Massa do solvente = 950
g
Massa da solução = 1000
g
RESOLUÇÃO
1000 g da solução ------------------ 100%
50 g do soluto ------------------ X
X = 5% de soluto ou Título = 50/1000 =
0,05
PARTES POR MILHÃO
(PPM)Observe a seguinte informação:
A análise química do esgoto descarregado no rio de uma cidade de tamanho médio mostra que contém 0,0030% de íons fosfato, que é muito prejudicial aos ecossistemas aquáticos.
Significado: "Há 0,0030 g (ou Kg ou tonelada) de íons fosfato em cada 100 g (ou kg ou tonelada) de água do rio."
Observe que o valor 0,0030 é muito pequeno, por isso torna-se mais fácil multiplicar este número por 10.000 e, dessa forma, obtêm-se a seguinte relação:
"Há 30 g de íons fosfato em cada 1.000.000 g (um milhão de gramas) de água do rio."
Esta afirmação poderá ser expressa da seguinte forma:
30 ppm (m/m), que significam 30 partes de íons fosfato em massa por um milhão de partes de água do rio em massa.
Desta forma, podemos afirmar que:
Partes por milhão (ppm) indica a relação de 1 parte do soluto por 1 milhão de partes do solvente. Para soluções muito diluídas, considerar o volume do solvente igual ao volume da solução.
Ou ainda:
30 ppm: 30 g de soluto por 1.000.000 g da solução
Equivalem a:
30 g de soluto por 1.000 kg de solução, ou
30 g de soluto por 1 tonelada de solução, ou
30 mg de soluto por 1.000.000 mg de solução, ou
30 mg de soluto por 1.000 g de solução, ou
30 mg de soluto por 1 kg de solução.
Analogamente, teremos:
Porcentagem: referência a um total de 100 (102)
Partes por mil: referência a um total de 1.000 (103)
Partes por milhão: referência a um total de 1.000.000 (106)
Partes por bilhão: referência a um total de 1.000.000.000 (109)

A
PETROBRÁS descumpriu a resolução do Conselho Nacional do Meio Ambiente (Conama,
de 2002, que estabelecia que os níveis de enxofre no diesel deveriam ser
reduzidos a partir de janeiro de 2009 para 50 partes por milhão (ppm) – mesmo
padrão europeu. Hoje as regiões metropolitanas recebem o óleo com 500 ppm de
enxofre, e o resto do País, com 2 mil ppm de enxofre.


Mercúrio é um metal líquido altamente tóxico a qualquer forma de vida,
sendo utilizado na garimpagem de ouro. Depois de retirado,o cascalho do rio é
misturado ao mercúrio liquido.O ouro em pó do cascalho se aglutina ao mercúrio e
o resto é jogado fora.Aquece-se então a mistura mercúrio/ouro até que os dois se
separam.Durante esse processo, 55% do mercúrio evapora; o restante acaba sendo
jogado nos rios. Para cada quilo de ouro retirado dos rios brasileiros, usa-se
de 1,5 a 3 quilos de mercúrio.No leito dos rios o mercúrio reage com os
sedimentos orgânicos e é consumido pelos peixes.A outra parte que evaporou acaba
se condensando e assumindo sua forma líquida original.Daí temos a poluição dos
rios,terras,vegetação,meio ambiente e, finalmente, do homem.A tolerância do
mercúrio nos seres humanos é de 0,02 ppm(partes por milhão) no sangue e de 0,2
ppm na urina.Na natureza, os teores de mercúrio são baixos,chegando a 1 ou 2 ppm
em certos solos.Alguns garimpos brasileiros já apresentaram contaminação até 2
mil vezes superior à tolerância biológica.Em Serra Pelada, no Pará,a amostra do
cabelo de um garimpeiro mostrou uma taxa de 2,92 ppm de mercúrio.Muitos peixes
migram para outros rios para a desova; assim, peixes contaminados pelo mercúrio
de um rio,podem levar essa poluição a outras regiões.O garimpo de ouro muitas
vezes utilizam mercúrio contrabandeado, o que torna a operação ilegal. Muito
ouro extraído sai do Estado de forma ilegal, sem tributação.
RELAÇÃO MASSA/MASSA
Exemplos
1) Solução 20 ppm (m/m)
Significado: 20 g de soluto em 1 milhão de gramas da solução
Obs.: Como a solução é muito diluída, a massa do solvente é praticamente a massa da solução.
2) 10 ppm de O2 na água (m/m)
Significado: 10 g de O2 dissolvidos em 1 milhão de gramas de água, ou ainda, 10 mg de O2 dissolvidos em 1 milhão de miligramas de água.
Obs.: Como 106 mg = 1 kg, ou ainda, 1 ton = 106 g
Desta forma ficamos com: 10 g de O2 dissolvidos em 1 ton de água, ou ainda, 10 mg de O2 dissolvidos em 1 kg de água.
Com isso poderemos representar ppm (m/m) pelas relações matemáticas:


Como se expressa em ppm a padronização: 5 . 10-4 mg de Hg/grama de água.
Dados:
Massa do soluto = 5 . 10-4 mg
Massa do solvente = Massa da solução = 1 g = 10-3
kg
Resolução
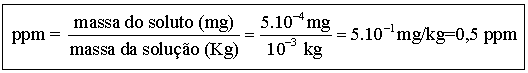
5 .
10-4 mg de Hg ------------------ 10-3 kg de água
(1g)
X ------------------ 1 kg (1
ppm)
X = 0,5 mg/kg ou
0,5 ppm
RELAÇÃO MASSA/VOLUMEComo a água possui d = 1 g/mL ou 1 kg/L, logo temos: massa = volume
desta forma ficamos com: 1g de H2O = 1 mL de H2O, ou ainda, 1 kg H2O = 1 L de H2O
Exemplos
1) A água imprópria para consumo possui 0,5 ppm em íons Pb2+.
Significado (m/m): 0,05 g de Pb2+ em 106 g de H2O
Como 106 g de H2O = 106 mL, então:
Significado (m/v): 0,05 g de Pb2+ em 106 mL de H2O
Como: 106 mL = 103 L
Então ficamos com:
Significado (m/v): 0,05 g de Pb2+ em 103 L de H2O ou 0,05 mg de Pb2+ em 1 L de H2O.
Com isso poderemos representar ppm (m/v) pelas relações matemáticas:


Exercício resolvido
Uma xícara de chá preto contém 0,3 mg de flúor. Se o volume de água na xícara é de 200 mL, qual a concentração em ppm do flúor nesta solução?
Dados:
Massa do soluto = 0,3 mg
Volume da solução = 200 mL = 0,2
L
Resolução
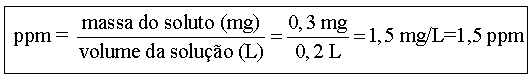
0,3 mg de Hg ------------------ 0,2 L de
solução
X ------------------ 1 L (1
ppm)
X = 1,5 mg/L ou 1,5
ppm
RELAÇÃO
VOLUME/VOLUMEExemplo
Ar considerado bom deve ter concentração de CO no máximo 4,5 ppm ao longo de 8 horas.
Significado 4,5 ppm (v/v): 4,5 L de CO em 106 L de ar, ou ainda, 4,5 mL de CO em 106 mL de ar
Como: 106 mL = 103 L = 1 m3, logo ficamos com:
4,5 mL de CO em 1 m3 de ar.
Com isso poderemos representar ppm (v/v) pela seguinte relação matemática:

Existem duas formas de concentração de menor importância apresentamos a seguir:
1. Fração Molar do Soluto (x1) e do Solvente (X2)
A fração do soluto (x1), em uma solução, é a relação entre a quantidade em mols do soluto (n1) e a quantidade total em mols das substâncias que constituem a solução (n).
n1 = quantidade em mols do soluto
n2 = quantidade em mols do solvente
n = quantidade em mols da solução
Analogamente, para a fração molar do solvente, pode-se escrever:
Observação
Exemplo:
A 40 g de NaOH, adicionou-se 900 g de água. Qual a fração molar do soluto e a do solvente, nesta solução?
dados:
NaOH = 40 g/mol
H2O = 18 g/mol
(1) NaOH
(2) H2O
m1 = 40 g
M1 = 40 g/mol
M2 = 18 g/mol
x1 = ?
x2 = ?
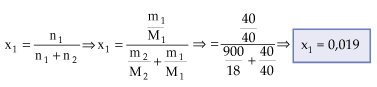
Como x1 + x2 = 1, x2 = 1 - 0,019 →
2. Molalidade (W)
Indica a quantidade em mols de soluto presente em 1 kg de solvente.
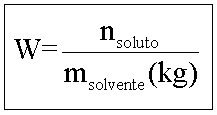
Preparou-se uma solução dissolvendo 80 g de NaOH em 500 g de água. Qual a molalidade da referida solução?
Dados: Na = 23; O = 16; H = 1
Soluto (1) NaOH
Solvete (2) H2O
m1 = 80 g
M1 = 40 g/mol
m2 = 500 g = 0,5 kg
W = ?
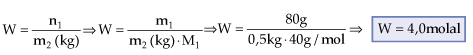
DILUIÇÃO
Diluir uma solução consiste em adicionar uma quantidade de solvente puro, que provoca uma mudança no volume, mudando com isso a proporção soluto/solvente e, portanto, a concentração da solução se altera (diminui).
Consideremos o seguinte sistema:
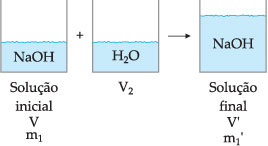
Para a solução final:
Como foi adicionado apenas solvente, não alteramos a quantidade de soluto (m1 = m'), portanto:
C · V = C’ · V’
Utilizando o título,
encontramos: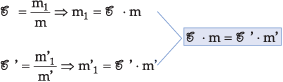

Observação
Concentrar uma solução significa aumentar a concentração pela retirada de solvente. O solvente é retirado por meio de uma evaporação, desde que o soluto não seja volátil. As fórmulas utilizadas são as mesmas apresentadas anteriormente, apenas, ao invés de aumentar o volume final, ele deve diminuir.
Quanto de água deve ser acrescentado à 100 mL de álcool 96%(v) a fim de transformá-lo 46%(v).
Resolução
1ª Opção (Utilizando a
fórmula)% . V = %' . V' → 96 . 100 = 46 . V' → V' = 208,7 mL
Vágua = V' - V = 208,7 mL - 100 mL → Vágua = 108,7 mL
2ª Opção (Interpretação por regra de três)
Antes da diluição:
Vsolução = 100 mL
%soluto = 96% (v) → 96 mL
Após a diluição
%soluto = 46% (v) → 46 mL
Vsolução = ?
100 mL de solução
→ 96 mL de
soluto
X → 46 mL de soluto
X =
208,7 mL de solução
Cálculo do volume de água
acrescentado:Vágua = Vapós a diluição - Vantes da diluição → Vágua = 208,7 - 100 = 108,7 mL
Mistura de Soluções de Mesmo Soluto
Consideremos o esquema abaixo:
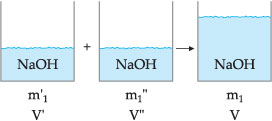

Utilizando o título, o raciocínio é o mesmo, portanto:

Exercício resolvido
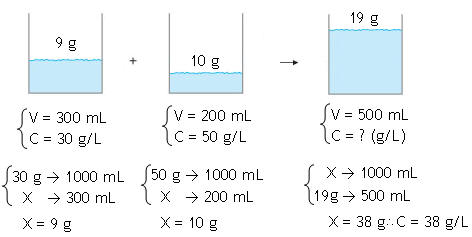
Calcule a concentração (g/L) de um detergente proveniente da mistura de 300 mL de detergente 30 g/L com 200 mL de detergente 50 g/L.
Resolução
1ª Opção (Utilizando a
fórmula)C . V = C' . V' + C" . V" → C . 0,5 = 30 . 0,3 + 50 . 0,2 → C . 0,5 = 9 + 10 → C = 38 g/L
2ª Opção (Interpretação por regra de três)
Misturas de Soluções com Reação Química
Neste caso, os exercícios são resolvidos como na estequiometria, ou seja:
a) montar a equação química:
b) balancear a equação química;
c) determinar a quantidade em mols de cada reagente;
d) fazer a proporção em mols.
Exemplo
Misturam-se para reagir 1,0 L de solução 2,0 M de NaOH, com 0,5 L de solução 4,0 M de HCl.
a) A solução final, após a mistura, será ácida, básica ou neutra?
b) Calcule a concentração molar da solução final em relação ao sal formado.
Esquematicamente, temos:
Resolução
1o passo: montar a equação envolvida na mistura, balanceá-la e relacionar os coeficientes com quantidades em mols de reagentes e produtos.
Respostas
a) A solução final será neutra.
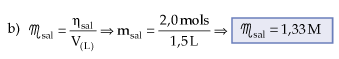
Titulação

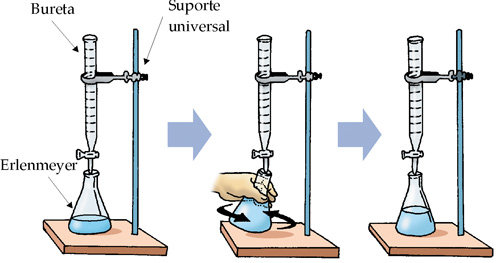
Exemplo
Retiramos, com auxílio de uma pipeta, 50 mL da solução contida no frasco abaixo, (observe que a solução possui concentração molar desconhecida) e transferimos para um frasco erlenmeyer.
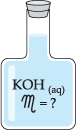
Com o auxílio de uma bureta (figura a seguir), adicionamos cautelosamente à solução contida no erlenmeyer uma solução de HCl(aq) 2,0 M.
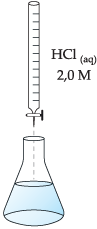
1 HCl(aq) + 1 KOH(aq)  1 KCl(aq) + 1 H2O(l)
1 KCl(aq) + 1 H2O(l)
Pela equação, observaremos que a neutralização entre o ácido e a
base será completa quando o número de mols de Esse fato é verificado exatamente no momento em que a coloração vermelha, devido ao meio básico, muda para incolor. Neste momento, o número de mols
Anotamos o volume de ácido gasto (25 mL), e calculamos quantos mols do ácido foram utilizados para reagir completamente com a base.
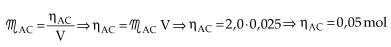
Vejamos agora como se calcula a concentração molar do KOH(aq):
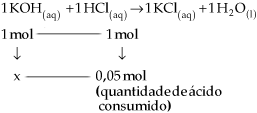
x = quantidade em mols de OH– presente no erlenmeyer = 0,05 mol
Assim, para calcular a concentração molar da base:
Exercício resolvido
Por lei, o vinagre (solução aquosa de ácido acético) pode conter, no máximo 4% em massa (0,67 mol/L) de ácido acético. Para você verificar se o vinagre utilizado em sua casa atende às especificações legais, para isso você verifica que 40 mL de vinagre são neutralizados por 8 mL de solução aquosa de NaOH 2 M. A que conclusão você chegou?
Dados:
Vinagre: V = 40 mL = 0,04 L, [ác. acético] = ? (mols/L)
NaOH(aq): V = 8 mL = 0,008 L, [NaOH] = 2 mols/L
RESOLUÇÃO
Cálculo do número de mols de NaOH que
reage:2 mols de NaOH → 1 L de solução
X → 0,008 L de solução
X = 0,016 mol
Cálculo do número de mols de ác. acético que será neutralizado pelo NaOH:
CH3-COOH + NaOH → CH3-COO-Na+ + H2O
1 mol 1 mol
X 0,016 mol
X = 0,016 mol
Cálculo da [ác. acético] no vinagre:
0,016 mol de ác. acético → 40 mL de vinagre
X → 1000 mL de vinagre (1 L)
X = 0,4 mol, com isso temos que: [ác. acético] = 0,4 mol/L
Como a concentração de ác. acético máxima exigida por lei, no vinagre, é de 0,67 mol/L, com isso concluímos que a amostra de vinagre analisada não atende às especificações exigidas.








0 comentários:
Postar um comentário