Efeito Estufa
Tópicos
- O que é efeito estufa?
- Por que a preocupação com o efeito estufa?
- Quais são os principais gases de efeito estufa?
- O que é o protocolo de Kyoto?
- Como podemos saber qual era a concentração de CO2 na atmosfera há milhares de anos atrás?
- Como o CO2 pode ser naturalmente retirado da atmosfera?
- O que eu posso fazer para diminuir minha emissão de CO2 para a atmosfera?
- Veja alguns dados sobre reciclagem
- Aqui vão algumas dicas para você se tornar um cidadão que preserva o meio ambiente:
Para reflexão:
- Por que existe uma preocupação tão grande com relação ao efeito estufa?
- O que pode ser feito para diminuir o efeito estufa?
- O que cada um de nós pode fazer?
O que é efeito estufa?
Você já pensou porque o interior do carro com os vidros fechados se aquece tão rapidamente? O sol emite radiações em todos os comprimentos de onda, mas a maior parte está dentro da faixa da luz visível (de 380 a 750 nm – Figura 1), que passa pelo vidro para dentro do carro. Parte dessa energia é absorvida pelos materiais no interior do carro e parte é refletida de volta. Essa energia refletida é a radiação infravermelha (de 4 a 40 µm), que por ter um grande comprimento de onda não passa pelo vidro, ficando aprisionada. Sendo assim fica fácil deduzir que haverá um armazenamento de energia dentro do carro provocando um aumento na temperatura, pois nem toda a energia que entrou sairá. Esta pode ser considerada uma analogia para o efeito estufa global.
Gases como o gás carbônico (CO2), o metano (CH4) e o vapor d'água (H2O) funcionam como uma cortina de gás que vai da superfície da Terra em direção ao espaço, impedindo que a energia do sol absorvida pela Terra durante o dia seja emitida de volta para o espaço. Sendo assim, parte do calor fica “aprisionado” próximo da Terra (onde o ar é mais denso), o que faz com que a temperatura média do nosso planeta seja em torno de 15°C. A esse fenômeno de aquecimento da Terra dá-se o nome de efeito estufa. Se não existisse o efeito estufa a temperatura média na Terra seria em torno de –15°C e não existiria água na forma líquida, nem vida.
Gases como o gás carbônico (CO2), o metano (CH4) e o vapor d'água (H2O) funcionam como uma cortina de gás que vai da superfície da Terra em direção ao espaço, impedindo que a energia do sol absorvida pela Terra durante o dia seja emitida de volta para o espaço. Sendo assim, parte do calor fica “aprisionado” próximo da Terra (onde o ar é mais denso), o que faz com que a temperatura média do nosso planeta seja em torno de 15°C. A esse fenômeno de aquecimento da Terra dá-se o nome de efeito estufa. Se não existisse o efeito estufa a temperatura média na Terra seria em torno de –15°C e não existiria água na forma líquida, nem vida.
Figura 1: Espectro da luz solar.
Topo Por que a preocupação com o efeito estufa?
Se o aquecimento da Terra pelos gases estufa permite que o nosso clima seja mais ameno, então por que nos preocupar com o efeito estufa? O grande problema é que o efeito estufa está aumentando muito rapidamente neste último século, pois está havendo uma alta emissão de gases como gás carbônico, metano e óxido nitroso para a atmosfera. A principal fonte de gás carbônico é a queima de combustíveis fósseis (carvão, gasolina, diesel) e as queimadas das florestas. Nestes últimos 140 anos, a temperatura do nosso planeta aumentou em média 0,76 oC. Pode parecer pouco, mas esse aumento já foi suficiente para abalar o clima do planeta.Pesquisadores do Reino Unido observaram que o aumento da temperatura naquele país fez com que a atividade microbiana do solo aumentasse, aumentando assim a emissão de CO2 que estava retido no solo.
O chamado IPCC, Painel Intergovernamental sobre Mudanças Climáticas (Intergovernamental Panel on Climate Change), conta com a participação de cerca de 2500 cientistas e técnicos que tem como objetivo avaliar e relatar as variações climáticas e impactos ambientais de forma objetiva e compreensível. As avaliações do IPCC são utilizadas mundialmente pelos tomadores de decisões (no nível político) e cientistas. As projeções do órgão são dependentes de como todos os países e pessoas individualmente atuarão para minimizar as emissões de gás carbônico. Portanto, as projeções são variáveis, e o aumento de temperatura para o final do século XXI pode ser em média de 1,8 (na melhor das hipóteses) a 4,0 oC (no pior cenário). O nível do mar pode subir de 18 a 59 cm. Além do aumento da temperatura global também foi registrado que o nível do mar subiu em média 17 cm no século XX, levando a grandes inundações de terra. Uma população inteira de uma Ilha do Pacífico checou a ser evacuada, fazendo com que seus habitantes perdessem seus lares e suas identidades culturais. (Elevação do nível do mar força evacuação de Ilha-Nação)
Topo
Quais são os principais gases de efeito estufa?
O gás carbônico não é o único gás capaz de impedir que a radiação infravermelha emitida da Terra escape. Na verdade este contribui com cerca de 53 % do total dos gases estufa, sendo que outros gases produzidos pelas atividades humanas também contribuem para o efeito estufa: metano (17%); CFCs (12%), e óxido nitroso (6%), entre outros (Tabela 1). Além de estar em maior porcentagem, a concentração do gás carbônico vem aumentando rapidamente nas últimas décadas.
A Tabela 1 mostra que nem todos os gases de efeito estufa absorvem igualmente o calor. Veja que uma molécula de metano absorve com uma eficiência 23 vezes maior os raios infravermelhos que uma molécula de gás carbônico. Já uma molécula de CFC-12, gás que foi muito utilizado em geladeiras, tem um poder de aquecimento por molécula, 8.100 vezes maior que o gás carbônico. A maior fonte de óxido nitroso está nos processos naturais devido às atividades biológicas no solo e nos oceanos, mas a manipulação do solo pelo homem, principalmente devido o uso de fertilizantes vem aumentando a emissão desse gás para a atmosfera. O ozônio nas camadas mais baixas da atmosfera (a troposfera) além de ser um gás extremamente nocivo para a saúde humana, também tem um elevado poder de aquecimento. A água tem grande capacidade para armazenar calor, mas não se enquadra nos ‘gases de efeito estufa’ propriamente dito porque a quantidade de água na atmosfera depende dos outros gases. Isto é, quanto maior a temperatura da atmosfera, maior a evaporação da água dos rios, oceanos e de outros reservatórios. Sendo assim, se a concentração dos gases de efeito estufa aumentar devido a ação do homem, o aumento do vapor de água da atmosfera será uma conseqüência disso.
Se a emissão de gás carbônico continuar aumentando na mesma velocidade dos últimos anos, a temperatura do planeta poderá aumentar tanto que os desastres previstos são muito grandes. Por exemplo, o gelo das regiões polares poderá derreter, causando inundações de grande parte da costa dos continentes, sendo que cidades litorâneas inteiras poderão desaparecer. As correntes oceânicas poderão ser afetadas de forma a alterar a distribuição de calor na Terra, grandes regiões agrícolas poderão se tornar desertos, e tempestades violentas poderão ocorrer com mais freqüência por causa das variações climáticas.
A Figura 2 mostra que nos anos 50 a concentração de CO2 na atmosfera era cerca de 315 ppmv (parte por milhão em volume – porque se trata de ar), e em apenas 5 décadas houve um aumento de cerca de 16%. Esse aumento tão rápido e tão intenso nunca foi observado na história do planeta. O zigue-zague observado na Figura 2 é por causa do aumento de CO2 na atmosfera durante o outono-inverno devido à baixa atividade fotossintética, já no período de primavera-verão a fotossíntese é mais eficiente, diminuindo então a concentração de CO2 na atmosfera. O aumento de CO2 de um ano para outro é controlado pela atividade humana, principalmente devido à queima de combustível fóssil.
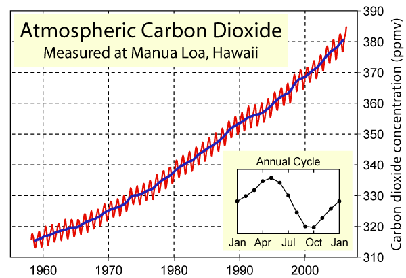
Figura 2: Variação na concentração de CO2 na atmosfera medida no Observatório de Mauna Loa no Havaí localizado a 3.500 m de altitude.
TopoO que é o protocolo de Kyoto?
A preocupação com o efeito estufa é tão grande que 141 países assinaram um acordo internacional que visa diminuir a emissão de gás carbônico para a atmosfera. Este acordo foi chamado de “Protocolo de Kyoto” (cidade no Japão onde se concluiu o documento). O protocolo de Kyoto, que entrou em vigor em fevereiro de 2005, diz que os países desenvolvidos (que fazem parte do acordo) se comprometem a reduzir até 2012 a emissão de gases de efeito estufa em pelo menos 5%, de acordo com os níveis de 1990. Em outras palavras, cada país avalia o quanto emitia de gases estufas no ano de 1990 e deve passar a emitir 5% menos dentro do prazo estipulado. Os Estados Unidos, que são os maiores emissores de gases de efeito estufa do mundo (respondendo por 36 % do total mundial) não ratificaram (não transformaram em lei) o acordo. Juntos, EUA, Rússia, Alemanha, Grã Bretanha e Japão respondem por 70% das emissões acumuladas de gases de efeito estufa.
É importante enfatizar que este protocolo foi apenas o início de um esforço mundial para minimizar as emissões de gases de efeito estufa. Hoje se fala em acordos mundiais 'pós Kyoto", pois já há muitas evidências sobre a necessidade de se diminuir drasticamente tais emissões.
TopoÉ importante enfatizar que este protocolo foi apenas o início de um esforço mundial para minimizar as emissões de gases de efeito estufa. Hoje se fala em acordos mundiais 'pós Kyoto", pois já há muitas evidências sobre a necessidade de se diminuir drasticamente tais emissões.
Como podemos saber qual era a concentração de CO2 na atmosfera há milhares de anos atrás?
Imagine que a neve que caiu sobre a Antártida há milhares de anos ainda está lá soterrada, pois esta não derreteu desde então. Se a neve for escavada e trazida para a superfície, é possível cortar o gelo em fatias, determinar sua idade, e recuperar os gases que estavam na atmosfera há milhares de anos atrás. Os cilindros de gelos escavados são chamados de ‘testemunho’ e são extremamente valiosos como fonte de informação sobre o clima na Terra no passado, visto que à medida que a neve precipita, esta carrega consigo (deixa preso) os gases presentes na atmosfera. Ao derreter esse material em condições controladas, os gases que estavam presos na neve foram liberados e analisados, tornando possível determinar a composição da atmosfera na época em que a neve caiu, sendo possível avaliar o clima do planeta no passado. A Figura 3 mostra a concentração de gás carbônico e de metano na atmosfera até 420 mil anos atrás e faz uma correlação com as variações de temperatura nesse período. O bloco de gelo que é retirado é chamado de testemunho, e a este bloco em particular (retirado em partes) foi dado o nome de "testemunho de Vostok". Note que quando a temperatura sobe, a concentração dos gases também aumenta, mostrando a forte correlação entre essas variáveis. Alguns céticos dizem que a oscilação de gases na atmosfera é um efeito natural visto que há milhares de anos isso já foi observado, porém os resultados da análise do testemunho de Vostok (Figura 3) mostra que apesar da concentração de gases de efeito estufa terem variado grandemente durante a história do planeta (resultando nos chamados períodos glaciais e interglaciais), nunca houve um aumento tão abrupto e tão intenso na concentração de CO2 como se está sendo observado hoje.
TESTEMUNHO DE GELO: VOSTOK: volta ao tempo em 420 mil anos
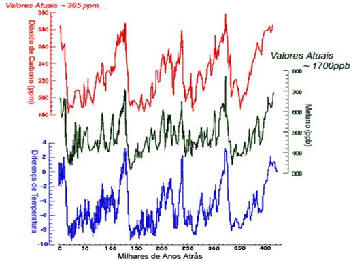
Figura 3: Relação entre as concentrações dos gases CO2 e CH4 com a variação da temperatura nos últimos 420 mil anos.
TopoComo o CO2 pode ser naturalmente retirado da atmosfera?
Os oceanos absorvem grande parte do gás carbônico da atmosfera por dois motivos: um porque o gás se dissolve na água (lembre-se que 2/3 do planta é coberto por água) e outro porque as pequenas algas marinhas durante o processo de fotossíntese consomem CO2. Os oceanos podem ser considerados como o grande “consumidor” do CO2 atmosférico. Porém, vale lembrar que é possível dissolver maiores quantidades de um gás em águas mais frias. Se a temperatura das águas dos oceanos aumentarem, como conseqüência do efeito estufa, sua capacidade de absorver o CO2 da atmosfera irá diminuir.As florestas também são muito importantes para a absorção de CO2, principalmente quando estão crescendo, pois estas também transformam o CO2 atmosférico em matéria orgânica sólida por meio da fotossíntese, “limpando” a atmosfera. Portanto, um aumento no número de árvores plantadas (e não derrubadas) pode ajudar a diminuir a concentração de CO2 na atmosfera. No processo de queima de florestas, o gás carbônico que estava armazenado durante anos e anos na forma de plantas, é emitido de volta para a atmosfera em minutos.
Topo
O que eu posso fazer para diminuir minha emissão de CO2 para a atmosfera?
A natureza está fazendo a parte dela. E você, está fazendo a sua?
Você conhece a regra dos 3 Rs? A regra dos 3 Rs significa: Reduzir; Reutilizar e Reciclar. Qualquer um dos “Rs” só irá acontecer se houver um programa de EDUCAÇÃO da população. Use a regra e seja um cidadão “de bem” com a natureza.
Cada um de nós é responsável pela emissão de uma parcela de CO2 para a atmosfera, pois consumimos produtos industrializados e usamos carros ou ônibus para nos locomover. Um norte americano ou europeu, em média, é responsável pela emissão de 5 toneladas de CO2 por ano, enquanto que em países não industrializados, essa média cai para 0,5 tonelada. Portanto, para contribuir menos para o efeito estufa basta consumir menos (reduzir o consumo!!). Mas como fazer isso numa sociedade com tantos apelos ao consumo?
Para cada tonelada de papel reciclado, de 10 a 20 árvores são poupadas. Isto representa uma economia de recursos naturais, as árvores não cortadas continuam absorvendo CO2 pela fotossíntese, e gasta-se a metade da energia para reciclar o papel que para produzi-lo pelo processo convencional. Uma latinha reciclada economiza em energia o equivalente ao consumo de um televisor ligado por 3 horas. Veja que quando falamos em economia de energia, isto representa uma economia de combustível que seria queimado pela indústria, que implica numa redução na emissão de gás carbônico para a atmosfera, que implica numa diminuição do efeito estufa. O Brasil é o país que mais recicla as latas de alumínio (refrigerante, cerveja) no mundo, chegando a 96% em 2004.
TopoPara cada tonelada de papel reciclado, de 10 a 20 árvores são poupadas. Isto representa uma economia de recursos naturais, as árvores não cortadas continuam absorvendo CO2 pela fotossíntese, e gasta-se a metade da energia para reciclar o papel que para produzi-lo pelo processo convencional. Uma latinha reciclada economiza em energia o equivalente ao consumo de um televisor ligado por 3 horas. Veja que quando falamos em economia de energia, isto representa uma economia de combustível que seria queimado pela indústria, que implica numa redução na emissão de gás carbônico para a atmosfera, que implica numa diminuição do efeito estufa. O Brasil é o país que mais recicla as latas de alumínio (refrigerante, cerveja) no mundo, chegando a 96% em 2004.
Veja alguns dados sobre reciclagem (Fonte principal www.multilixo.com.br)
- De 10 a 20 árvores são poupadas por cada tonelada de papel reciclado.
- O processo de reciclagem de papel economiza mais de 50% da energia utilizada no processo convencional.
- Minimiza a poluição por gazes e efluentes, que é muito grave nas fábricas de celulose.
- Utiliza 50 vezes menos água na produção.
Reciclagem de plástico
- Há economia de recursos não renováveis como o petróleo
- A reciclagem economiza 90% da energia utilizada no processo normal de fabricação
- Diminui o volume de lixo a ser aterrado, pois sua decomposição no solo pode ser superior a 200 anos.
Reciclagem de vidros
- Não altera o ecossistema através da extração da areia, barrilha, calcário, feldspato e outros minerais.
- Economiza energia, pois o caco de vidro funde a temperaturas mais baixas.
- Minimiza a produção de gases tóxicos (reduz a poluição)
- Diminui o volume de lixo nos aterros sanitários, pois a decomposição do vidro no solo é superior a 2000 anos.
Reciclagem de metais
- Uma latinha reciclada economiza em energia o equivalente ao consumo de um televisor ligado por 3 horas. A reciclagem do alumínio representa uma economia de 95% da energia necessária no processo convencional.
- A fabricação de alumínio a partir da bauxita produz grandes quantidades de subprodutos poluentes.
- Para cada kg de alumínio reciclado, se economiza 5 kg de bauxita.
Com a reciclagem do lixo consegue-se:
- Reduzir o consumo de energia e água
- Reduzir os custos de produção devido ao reaproveitamento de recicláveis pelas indústrias de transformação
- Gerar recursos que podem ser empregados na área social
- Mudar o comportamento em relação ao desperdício
- Fortalecer uma nova mentalidade ambiental
Aqui vão algumas dicas para você se tornar um cidadão que preserva o meio ambiente:
- Não aceite sacolas plásticas se dá para carregar sua compra sem ela, ou se vai jogar fora depois.
- Só aceite outra sacola plástica se aquela que você tiver nas mãos já estiver totalmente cheia.
- Escreva dos dois lados do papel.
- Sempre que puder consuma bebidas que vem em recipientes retornáveis.
- Evite comprar alimentos com muita embalagem.
- Economize energia e água.
- Ande mais a pé e de bicicleta.
- Eduque seu filho, amigo, vizinho.
- Recicle papel, latas, vidros, e plásticos.
©2006 LaQA - Laboratório de Química Ambiental
texto 2
Poluição Atmosférica &
Chuva ácida
Tópicos
- O que é chuva ácida?
- Como é formada a chuva ácida?
- Algumas conseqüências da elevada emissão de SO2
- O ar poluído pode ser transportado?
- Experimento & Questões
Para reflexão:
- O que causa um excesso de acidez na água de chuva?
- Como a acidez da chuva poderia danificar o meio ambiente?
- O que pode ser feito para minimizar a emissão de contaminantes para a atmosfera? O que cada um de nós pode fazer?
O que é chuva ácida?
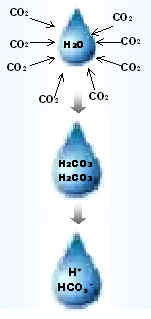 |
Sabemos que o pH da água pura é 7,0, mas quando o dióxido de carbono (CO2) presente na atmosfera se dissolve na água, ocorre a formação do ácido carbônico (H2CO3), e portanto o pH da água em equilíbrio com o CO2 atmosférico é de 5,6. Veja a figura e equações mostrando a formação e dissociação do ácido carbônico:
O2 (g) + H2O (l) → H2CO3 (aq)
H2CO3 (aq) → H+ (aq) + HCO3- (aq)
HCO3- (aq) → H+ (aq) + CO32- (aq)
|
O aumento da acidez na chuva ocorre principalmente quando há um aumento na concentração de óxidos de enxofre e nitrogênio na atmosfera. Estes óxidos e o óxido de carbono são chamados de óxidos ácidos, porque em contato com a água (neste caso água de chuva) formam ácidos.
Topo
Como é formada a chuva ácida?
O nitrogênio gasoso (N2) e o oxigênio molecular (O2) da atmosfera podem reagir formando o monóxido de nitrogênio (NO). No entanto, esta reação não é espontânea, necessitando de muita energia para ocorrer. Por exemplo, durante a queima de combustível no motor do carro ou em fornos industriais a temperatura é muito elevada, fornecendo a energia necessária para que ocorra a formação do monóxido de nitrogênio de forma eficiente.
N2 (g) + O2 (g) → 2 NO (g) (em altas temperaturas)
O monóxido de nitrogênio pode ser oxidado na atmosfera (que contém O2) e formar o dióxido de nitrogênio (NO2) que tem cor marrom. Muitas vezes, o fato do céu ter um tom marrom em cidades com tantos veículos como São Paulo, se deve à formação do NO2 na atmosfera, somado com a grande emissão de material particulado (incluindo a fuligem) que também escurece a atmosfera. O dióxido de nitrogênio pode sofrer novas reações e formar o ácido nítrico (HNO3), que contribui para aumentar a acidez da água de chuva.Um carro produzido em 1995 produz até 10 vezes mais NO que um carro produzido hoje. Isto porque os carros modernos possuem um conversor catalítico que reduz muito a formação do NO. O conversor catalítico (ou catalisador) contém metais como paládio, platina e ródio, que transforma grande parte dos gases prejudiciais à saúde e ao meio ambiente, em gases inertes como N2 e CO2. Devemos lembrar que o CO2 é um gás que não prejudica diretamente a saúde humana, mas colabora para aumentar o efeito estufa.
2CO (g) + 2NO (g)  2CO2 (g) + N2 (g)
2CO2 (g) + N2 (g)
2CO (g) + O2 (g)  2CO2 (g)
2CO2 (g)
2NO (g)  N2 (g) + O2 (g)
N2 (g) + O2 (g)
É importante salientar que com ou sem catalisador o carro continua emitindo imensas quantidades de CO2 para a atmosfera. O catalisador tem um papel importantíssimo, mas atua de forma a minimizar apenas as emissões de CO e NO.O dióxido de enxofre (SO2) é o responsável pelo maior aumento na acidez da chuva. Este é produzido diretamente como subproduto da queima de combustíveis fósseis como a gasolina, carvão e óleo diesel. O óleo diesel e o carvão são muito impuros, e contém grandes quantidades de enxofre em sua composição, sendo responsáveis por uma grande parcela da emissão de SO2 para a atmosfera. Atualmente no Brasil, a Petrobrás tem investido muito na purificação do diesel a fim de diminuir drasticamente as impurezas que contém enxofre.
De forma equivalente a outros óxidos, o SO2 reage com a água formando o ácido sulfuroso:
SO2 (g) + H2O (l) → H2SO3 (aq)
H2SO3 (aq) → H+(aq) + HSO3- (aq)
O dióxido de enxofre também pode sofre oxidação na atmosfera e formar o trióxido de enxofre (SO3), que por sua vez, em contato com a água da chuva irá formar o ácido sulfúrico (H2SO4), que é um ácido forte.
SO2 (g) + ½ O2 (g) → SO3 (g)
SO3 (g) + H2O (l) → H2SO4 (aq)
H2SO4 (aq) → 2H+ (aq) + SO42- (aq)
TopoAlgumas conseqüências da elevada emissão de SO2 .
A água de um lago em condições naturais tem o pH em torno de 6,5 – 7,0, podendo manter uma grande variedade de peixes, plantas e insetos, além de manter animais e aves que vivem no seu entorno e se alimentam no lago. O excesso de acidez na chuva pode provocar a acidificação de lagos, principalmente aqueles de pequeno porte. O pH em torno de 5,5 já pode matar larvas, pequenas algas e insetos, prejudicando também os animais que dependem desses organismos para se alimentar. No caso do pH da água chegar a 4,0 – 4,5, já pode ocorrer a intoxicação da maioria das espécies de peixes e levá-los até a morte.O solo também pode ser acidificado pela chuva, porém alguns tipos de solo são capazes de neutralizar pelo menos parcialmente a acidez da chuva por causa da presença de calcário e cal (CaCO3 e CaO) natural. Os solos que não têm calcário são mais suscetíveis à acidificação. A neutralização natural da água de chuva pelo solo minimiza o impacto da água que atinge os lagos pelas suas encostas (lixiviação). Uma chuva ácida provoca um maior arreste de metais pesados do solo para lagos e rios, podendo intoxicar a vida aquática.
Um outro fator muito importante sobre a emissão de SO2 é a formação de ácidos no corpo humano, a medida que respiramos. Este ácido pode provocar problemas como coriza, irritação na garganta e olhos e até afetar o pulmão de forma irreversível. No ano de 1952, na cidade de Londres, aproximadamente 4000 pessoas morreram em poucos dias como conseqüência da alta emissão de SO2 na atmosfera, proveniente da queima do carvão nas casas e nas indústrias naquela região. Normalmente esses gases eram dispersos para camadas mais elevadas na atmosfera, mas na época houve um fenômeno metereológico (inversão térmica) que causou um resfriamento súbito da atmosfera impedindo a dispersão dos gases. Hoje em dia a cidade de Londres tem uma atmosfera muito menos contaminada por SO2, e portanto um desastre de proporções tão grandes como as de 1952 é muito improvável de ocorrer.
A emissão de NO2, que provém principalmente da queima de combustíveis pelos carros também pode provocar problemas respiratórios e diminuir a resistências do organismo à vários tipos de infecções.
A acidez da atmosfera não só afeta aos seres vivos como também pode danificar a superfície de monumentos históricos e edifícios feitos de mármore (CaCO3 ) por causa da reação com o ácido. Podemos representar esse ácido de forma genérica (H+):
CaCO3 (s) + 2H+(aq) → Ca2+ (aq) + H2O (l) + CO2 (g)
TopoO ar poluído pode ser transportado?
Quando uma indústria emite gases e material particulado para a atmosfera, podemos ver que a fumaça "viaja" pelo ar. Desta forma, quando chover, esses contaminantes poderão ser depositados longe das fontes emissoras.Por exemplo, no Pólo Petroquímico de Cubatão (perto de Santos - SP) são emitidas toneladas de SO2 na atmosfera por ano, e a chuva que cai em cidades não industrializadas, a mais de 100 km de distância, muitas vezes é ácida por causa dessas indústrias. O SO2 produzido pela queima do carvão na Termoelétrica da Candiota no Rio Grande do Sul chega até o Uruguai, prejudicando o meio ambiente também daquele país. Esta é a chamada poluição trans-fronteiriça,isto é, ultrapassa as fronteiras de um país.
Depois da leirura, faça o experimento e as questões sobre chuva ácida.
Topo
Experimento e questões sobre chuva ácida
Recomendamos ler antes o texto de apoio!Texto de apoio
Experimento
Duração: aproximadamente 40 minutos.
Objetivos
Conscientizar o aluno de sua participação na emissão de gases poluentes que aumentam a acidez da atmosfera e conseqüentemente da chuva. Demonstrar a contribuição do SO2 para o aumento da acidez na chuva e discutir sobre a formação da chuva ácida, os malefícios da emissão de SO2, o transporte desse gás, os prejuízos que a chuva ácida causa, e como cada um pode contribuir para minimizar a acidez da chuva.MATERIAS
- 1 vidro com tampa (como os de maionese ou café solúvel)
- enxofre em pó (1 colher de chá cheia)
- 4 fitas de papel tornassol azul ( ~ 3 cm cada uma)
- 2 pétalas de flor colorida
- 1 colher de plástico
- 2 pedaços de fios de cobre ( ~ 15 cm cada um)
- 1 caixa de fósforos
- 1 caneta
PROCEDIMENTO
- Coloque uma fita de papel tornassol e uma pétala de flor na parte de dentro da tampa do vidro. Utilizando a colher de plástico, polvilhe um pouco do enxofre em pó sobre a fita e sobre a pétala (não utilize todo o enxofre, apenas o suficiente para manchar parte do papel tornassol e da pétala de flor). Anote suas observações na tabela de resultados.
- Coloque cerca de 5 cm de água da torneira no vidro, e com o auxílio da colher (limpa), retire um pouco de água e coloque sobre o enxofre que está sobre a pétala e o papel tornassol. Observe o que acontece com a água em contato com o enxofre, e se houve alteração na cor do papel tornassol e na pétala. Anote suas observações. Jogue no lixo o material sólido da tampa e lave a tampa.
- Pegue uma nova fita de papel tornassol e o umedeça com água. Anote suas observações.
- Monte o seguinte esquema Coloque em uma das extremidades do fio de cobre uma nova pétala e um pouco separado coloque um novo papel tornassol azul. Na outra extremidade do fio, faça um pequeno gancho e pendure por dentro do vidro que já tem um pouco de água. Tome cuidado para que a pétala ou fita não entrem em contato com a água. Veja a ilustração.
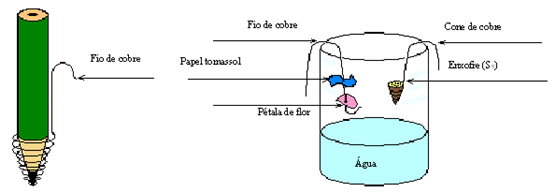
- Pegue o outro fio de cobre e enrole parte deste na ponta da caneta, formando um pequeno cone de cerca de 1 cm. Faça um pequeno gancho na outra ponta do fio, retire a caneta e encha o cone com enxofre em pó, com cuidado (use a colher). Pendure o fio de cobre por dentro do vidro (sem atingir a água).
- Posicione um fósforo aceso abaixo do cone para iniciar a queimar o enxofre e rapidamente retire o fósforo e tampe o vidro. Observe se o enxofre está realmente queimando. Aguarde 5 minutos e anote na tabela de resultados se houve mudança na coloração do papel e da pétala.
- Retire os fios de cobre de dentro do vidro rapidamente. Feche o vidro e agite a solução cuidadosamente.
- Umedeça nova fita de papel tornassol na água e anote suas observações.
PS. O papel tornassol azul é de cor azul em meio neutro e básico e se torna rosa em meio ácido.
NO FINAL DO EXPERIMENTO:
- NÃO JOGUE A ÁGUA ACIDIFICADA NA PIA. Armazene esta solução contendo o ácido sulfuroso em um recipiente grande para posterior neutralização.
- Jogue as pétalas e papel de tornassol no lixo. Os resíduos de enxofre podem ser jogados na pia, pois este elemento é bastante inerte. Lave todo material e retorne-os para sua bancada. Limpe e organize sua bancada.
Observações
| |
Pétala + enxofre em pó
| |
Papel tornassol + enxofre em pó
| |
Pétala + enxofre em pó + água
| |
Papel tornassol + enxofre + água
| |
Papel tornassol + água
| |
Dióxido de enxofre + pétala
| |
Dióxido de enxofre + papel de tornassol
| |
Dióxido de enxofre + água
|
QUESTÕES PARA DISCUSSÃO
Texto de apoio- Por que não há alteração na cor da pétala ou do papel tornassol no contato com enxofre em pó e com a água?
- Escreva a equação da reação de combustão do enxofre e a reação do gás produzido com a água.
- Por que após a combustão do enxofre, a pétala e o papel tornassol mudam de cor?
- Por que a água do experimento se tornou ácida?
- O que vem causando o excesso de acidez na chuva de grandes cidades?
- Cite um problema ambiental e um problema de saúde humana que pode ocorrer devido a emissão de dióxido de enxofre na atmosfera.
- Qual a equação que descreve a neutralização do excesso de acidez na chuva pela presença de calcário no solo?
- O que pode ser feito em termos de governo federal para diminuir a acidez, ou a poluição da atmosfera como um todo? E em termos de prefeitura? E você? O que você pode fazer para contribuir para minimizar a sua emissão de contaminantes para a atmosfera?
Desafio 1
Uma propriedade agrícola foi dividida em áreas numeradas de I a IV, de acordo com a acidez da terra. A 25°C, as concentrações hidrogeniônicas, em mol/L, detectadas nos respectivos solos são:I. [H +] = 1,0 . 10-6
II. [H +] = 2,0 . 10-6
III. [H +] = 1,0 . 10-7
IV. [H +] = 2,0 . 10-8
Desafio 2
Foi avaliado o pH de um grande número de amostras de água de chuva de uma cidade “A”, que possui uma grande frota automotiva e indústrias. O pH médio foi 4,5. Já para uma cidade remota (cidade B) pouco afetada por atividades antrópicas, o pH médio foi de 5,8. Calcule a diferença média na concentração de H+ da chuva das duas cidades. Por que na cidade “B” que tem baixo impacto humano o pH da água de chuva ainda é menor do que 7,0?
©2006 LaQA - Laboratório de Química Ambiental
texto 3
Combustão e Energia
Tópicos
Para reflexão:
- Por que quando o motor do carro está desregulado este gasta mais gasolina?
- Qual dos combustíveis, a gasolina, o álcool ou o diesel produz menos SO2?
- O que é um combustível 'limpo'?
Energia
O ser humano necessita de energia para tudo que faz, desde impulsionar o sangue para todas as partes de seu corpo, até fazer com que uma lâmpada se acenda ou que um automóvel se locomova. Mas como obter tal energia?Para o funcionamento do corpo utilizamos a energia dos alimentos. Já para a obtenção de energia elétrica, mecânica, etc... existem várias fontes, dentre elas estão:
- o biocombustível (álcool proveniente da cana de açúcar, ou diesel a base de óleo vegetal como de amendoim, soja, girassol, mamona, pequi, babaçu);
- a gasolina, (obtida pela destilação fracionada do petróleo);
- energia termoelétrica (obtida pela queima do carvão ou gás natural);
- a energia eólica (resultado do movimento do vento);
- a energia solar (aquece placas especiais que transformam essa energia em elétrica)
- a energia hidroelétrica (uso da energia das quedas d'água para acionar geradores)
- energia nuclear (baseada na fissão, ou seja, na divisão do átomo);
- o biogás (metano, CH4), também conhecido como gás natural (produzido pela fermentação e decomposição da matéria orgânica por microorganismos).

Combustão completa e incompleta
A combustão é uma reação de uma substância (combustível) com o oxigênio (O2) (comburente) presente na atmosfera, com liberação de energia.A liberação ou consumo de energia durante uma reação é conhecida como variação da entalpia (ΔH), isto é, a quantidade de energia dos produtos da reação (Hp) menos a quantidade de energia dos reagentes da reação (Hr):
ΔH = Hp - Hr
Quando ΔH > 0 isto significa que a energia do(s) produto(s) é maior que a energia do(s) reagentes(s) e a reação é endotérmica, ou seja, absorve calor do meio ambiente. Quando ΔH < 0, isto significa que a energia do(s) reagente(s) é maior que a energia do(s) produto(s) e a reação é exotérmica, ou seja, libera calor para o meio ambiente, como no caso da combustão da gasolina, por exemplo.A combustão completa de qualquer combustível orgânico (que possui átomos de carbono) leva a formação de gás carbônico ou também chamado de dióxido de carbono (CO2) e água (H2O). A respiração é um processo de combustão, de “queima de alimentos” que libera energia necessária para as atividades realizadas pelos organismos. É interessante notar que a reação inversa da respiração é a fotossíntese, que ocorre no cloroplasto das células vegetais, onde são necessários gás carbônico, água e energia (vinda da luz solar) para liberar oxigênio e produzir material orgânico (celulose) utilizado no crescimento do vegetal.
combustão/respiração
C6H12O6(s) + 6 O 2(g) ↔ 6 CO2(g) + 6 H2O (l) + energia
fotosíntese
A gasolina possui muitas impurezas contendo enxofre (S), e o diesel, ainda mais. Hoje no Brasil existe um grande investimento por parte da Petrobrás para diminuir a concentração de enxofre no diesel e assim torná-lo menos poluente. Portanto, combustíveis que tem enxofre, ao serem queimados produzem grandes quantidades de um gás bastante tóxico e corrosivo, responsável por acidificar a atmosfera, o dióxido de enxofre (SO2). Já o álcool é um combustível que não apresenta enxofre e portanto não produz o dióxido de enxofre.
S(s)+ O2(g ) → SO2(g)
A falta de oxigênio durante a combustão leva à chamada ‘combustão incompleta’ que produz monóxido de carbono (CO). Note que o CO tem um oxigênio a menos que o CO2, o que caracteriza a deficiência de oxigênio, ou a ineficiência da reação. Este gás é muito tóxico para o ser humano, pois este dificulta a função da hemoglobina, que é responsável pela renovação do oxigênio no nosso sangue. Pequenas concentrações de monóxido de carbono já provocam tonturas e dores de cabeça. Outro produto indesejável da combustão incompleta é a fuligem (C), que não tem oxigênio na sua constituição. A porção mais fina da fuligem pode impregnar nos pulmões e causar problemas respiratórios.As equações químicas abaixo ilustram a quantidade de calor (ΔH) liberada durante a combustão completa e incompleta do gás metano (CH4). Note como a quantidade de calor liberado é menor nos casos de combustão incompleta. Portanto, além da combustão incompleta gerar compostos nocivos à saúde humana, há também uma grande desvantagem econômica, pois com a mesma quantidade de combustível haverá menor quantidade de energia gerada! Veja as equações:
Combustão completa do metano:
CH4(g) + 2O2(g) → CO2(g) + 2H2O (l) ΔH = - 802 kJ/mol (energia liberada)
Combustão incompleta do metano:
CH4(g) + 3/2 O2(g) → CO(g) + 2H2O(l) ΔH = - 520 kJ/mol
CH4(g) + O2(g) → C(s) + 2H2O(l) ΔH = - 408,5 kJ/mol
É muito importante saber a quantidade de calor liberada pelos combustíveis para que seja possível comparar o valor energético de cada um deles. Na Tabela 1 são mostradas as entalpias de combustão (ΔHo) para alguns combustíveis, isto é, a energia liberada na queima completa de um mol do combustível. O zero utilizado como índice superior indica que as condições iniciais dos reagentes e as finais dos produtos são 25o C e 1 atm, chamadas de condições padrão.Tabela 1: Entalpia de combustão padrão para vários combustíveis.
COMBUSTÍVEL | FÓRMULA MOLECULAR |
ΔH° (kJ/mol)
|
Carbono (carvão)
|
C(s)
|
- 393,5
|
Metano (gás natural)
|
CH4 (g)
|
- 802
|
Propano (componente do gás de cozinha)
|
C3H8 (g)
|
- 2.220
|
Butano (componente do gás de cozinha)
|
C4H10 (g)
|
- 2.878
|
Octano (componente da gasolina)
|
C8H18 (l)
|
- 5.471
|
Etino (acetileno, usado em maçarico)
|
C2H2 (g)
|
- 1.300
|
Etanol (álcool)
|
C2H5OH (l)
|
- 1.368
|
Hidrogênio
|
H2 (g)
|
- 286
|
H2(g) + ½ O2(g) → H2O(l) ΔH = - 286 kJ/mol
Depois da leirura, faça o experimento e as questões sobre combustão e energia. Topo
©2006 LaQA - Laboratório de Química Ambiental
texto 4
Tratamento de Água
Tópicos
- O ciclo da água
- Breve histórico sobre tratamento de esgoto
- Como eu posso saber se estou gastando água mais do que o necessário?
- Como é feito o tratamento de água?
- Tratamento inicial
- Tratamento final
- Experimento & Questões
Para reflexão:
- Você acha que um dia a água pode acabar?
- Como você acha que é a qualidade de vida das pessoas que vivem em locais onde não há tratamento de água?
O ciclo da água
http://www.sabesp.com.br/sabesp_ensina/basico/ciclo/default.htm
As moléculas de água que evaporam dos oceanos, rios e lagos formam as nuvens. Uma vez que as nuvens ficam pesadas o suficiente pode então chover no mesmo local onde houve a evaporação. Mas se essas nuvens forem transportadas pelos ventos pode chover em outro local. Sendo assim, nós aqui em Ribeirão Preto (interior de SP), podemos ter na nossa chuva, moléculas de água que saíram lá de Santos (litoral) ou do interior do estado de Minas Gerais, e viajaram com os ventos até aqui. Estes processos de evaporação, transporte e precipitação (chuva ou neve) fazem parte do chamado ciclo da água.
As águas subterrâneas também evaporam, pois estas molham o solo, que transpira. As plantas também transpiram, e assim, as nuvens também são formadas pelas moléculas de água com origem no solo e plantas. A água da chuva é percolada para o interior do solo com a ajuda das raízes das plantas, e assim vai penetrando mais e mais fundo, formando os lençóis freáticos. Sem as plantas grande parte da água escoa para os rios sem ter tempo de ser armazenada no subsolo.
Se chovesse sempre a mesma quantidade de água que evapora e escoa de cada região, então o volume de água disponível não mudaria. Mas sabemos que há secas até em cidades como Manaus, onde costuma a chover muito.
Olhe a Figura que mostra o ciclo da água, e note que a flecha foi colocada no sentido de transportar as nuvens dos oceanos para o continente. E se o sentido mudar? E se começar a chover mais sobre os oceanos e menos sobre o continente? Faltará água doce para re-abastecer nossos mananciais. A grande seca que ocorreu na Amazônia em 2005 foi por que o regime de ventos mudou, e deixou de transportar grandes quantidades de ar úmido do Oceano Atlântico para a Amazônia. No Brasil, a maior parte da nossa energia elétrica vem do represamento dos rios, onde a força das águas move as turbinas das usinas hidrelétricas. Como todos sabemos, se faltar água, faltará também energia.
Topo
Breve histórico sobre tratamento de esgoto
Este item é baseado no texto do livro “Introdução à Química Ambiental” dos autores, Júlio C. Rocha, André H. Rosa e Arnaldo A. Cardoso, páginas 29-33, Editora Bookman, 2004.Quando poucos homens viviam sobre a Terra, estes viviam em grupos e eram nômades, isto é, se alimentavam de frutas, vegetais e animais de um certo lugar e quando a escassez aumentava, viajavam em busca de outro local mais farto. Estes grupos de humanos andavam próximos ao curso dos rios, que fornecia água, e não tinham moradias fixas. Quando abandonavam um local, a natureza degenerava o lixo que produziam.
Com o passar do tempo, o homem foi domesticando alguns animais para se alimentar, e as técnicas de agricultura também foram aprimoradas, ou seja, plantar o que comer. Com isso, este homem que antes viajava sempre que o alimento acabava, passou a se fixar em um determinado local, pois tinha o que precisava em torno de si. De nômade passou a ser sedentário. Com isso se deu início à manufatura, urbanização e industrialização. Junto com os benefícios se deu início às conseqüências ambientais maléficas como o acúmulo de lixo produzido. A taxa de lixo gerada era maior do que o tempo que a natureza levaria para degenerá-lo. Com o aumento do lixo acumulado, as condições para a proliferação de microorganismos e insetos também aumentaram e devido à proximidade com o homem, a disseminação de doenças também aumentou.
E o que fazer com o lixo produzido? Este era um sério problema enfrentado desde o primórdio das civilizações e a solução mais intuitiva era jogar no rio. Com a correnteza, o lixo seria levado para “longe” e se evitariam os problemas. Assim, deu-se início à contaminação das águas com o conhecido “esgoto doméstico”. Hoje sabemos que esta contaminação pode causar a morte de plantas e animais, comprometendo irremediavelmente o ecossistema local.
A primeira rede de distribuição de água e captação de esgoto de forma eficiente foi construída há aproximadamente 4.000 anos na Índia. Grandes tubos feitos de argila levavam as águas residuais e os detritos para canais cobertos que corriam pelas ruas e desembocavam nos campos, adubando e regando as colheitas.
Algumas cidades da antiga Grécia e a maioria das cidades romanas também dispunham de sistemas de esgotos. A população obtinha água para o abastecimento em fontes públicas e utilizava latrinas comunitárias para as necessidades fisiológicas, como a Toalete de Ephesus do século 1 d.C. Sob os assentos havia água corrente para levar os dejetos e para que o usuário lavasse a mão esquerda, utilizada na limpeza corporal.
A Idade Média (400 a 1400 d.C.) foi um período de 10 séculos sem avanços sanitários. Lixo de todo tipo se acumulava nas ruas, facilitando a proliferação de ratos e criando sérios problemas de saúde pública – um dos mais graves foi a epidemia da peste bubônica, que só na Europa, causou a morte de cerca de 25 milhões de pessoas.
No final do século XVIII, com a Revolução Industrial, a população das cidades aumentou muito causando agravamento do acúmulo de lixo e excrementos nas ruas. Isso tornou necessária e urgente a criação de um sistema de esgotos que desse conta da demanda, caso contrário, corria-se o risco de deter o progresso industrial pelo surgimento de novas epidemias e conseqüentemente êxodo das cidades. Os rios passaram a sofrer os efeitos da poluição, caracterizados pela morte dos peixes, do ecossistema, bem como a transmissão de doenças como a cólera.
Na Inglaterra surgiram as primeiras tentativas de medir e caracterizar a poluição, os primeiros regulamentos de proteção aos cursos d’água e os primeiros processos de tratamento de águas residuais. A primeira medida adotada foi a construção de sistemas de esgotos subterrâneos, o que ocorreu pela primeira vez em 1843 em Hamburgo, na Alemanha, quando a cidade foi reconstruída após um incêndio. Cientistas do século XIX concentraram esforços para combater as causas das diferentes doenças surgidas devido à falta de saneamento básico, o que impulsionou o desenvolvimento da microbiologia.
A primeira Estação de Tratamento de Água (ETA) foi construída em Londres em 1829 e tinha a função de coar a água do rio Tâmisa em filtros de areia. A idéia de tratar o esgoto antes de lançá-lo ao meio ambiente, porém, só foi testada pela primeira vez em 1874 na cidade de Windsor, Inglaterra. Não se sabia como as doenças “saíam do lixo e chegavam ao nosso corpo”. A idéia inicial é que vinham do ar, pois o volume de ar respirado por dia é muito superior ao volume de água ingerido. Porém com a descoberta de que doenças letais da época (como a cólera e a febre tifóide) eram transmitidas pela água, técnicas de filtração e a cloração foram mais amplamente estudadas e empregadas.
Atualmente, é consenso que o esgoto (efluente ou águas residuais), industrial ou doméstico, precisa ser tratado antes de ser lançado nos mananciais para minimizar seu impacto no meio ambiente e para a saúde humana. Esse tratamento é feito nas chamadas Estação de Tratamento de Esgoto (ETE). Infelizmente no Brasil, 62% da população não tem saneamento básico. Do esgoto coletado, menos de 20 % é tratado antes de ser devolvido para os rios e outros mananciais. Certamente a água nunca vai acabar, pois esta fica re-circulando entre os reservatórios (rios, oceanos, atmosfera), tanto na fase líquida, como na fase gasosa ou sólida. A questão é que quanto mais poluída for a água, mais caro será seu tratamento, e no futuro, a água de qualidade poderá ser privilégio de poucos.
Topo
Como eu posso saber se estou gastando água mais do que o necessário?
Estamos tão habituados com a abundância de água que esquecemos que ela é fundamental à vida de todos os seres humanos e à manutenção de todos os ecossistemas. Necessitamos da água para um simples banho, para beber, para a agricultura e para tantas outras necessidades que muitas vezes nem nos damos conta.O fato é que a quantidade de água doce disponível para tudo o que fazemos é muito pequena, perto de 3% do volume total existente, pois os outros 97% é de água salgada. Desses 3% de água doce, grande parte está na forma de gelo, portanto apenas 1% está acessível para a população de todo o planeta.
A quantidade mínima de água necessária para a vida de um ser humano varia de acordo com seu padrão de vida, o local em que mora, e seus hábitos. O consumo médio por indivíduo deveria ser de cerca de 300 L por dia, levando-se em conta que este vive em uma sociedade desenvolvida. Porém, para levar uma vida saudável, segundo a Organização Mundial da Saúde, o consumo mínimo de água potável diário seria de 50 L. No Brasil, é adotado como consumo de água necessário para uma vida confortável numa residência, de 150 a 200 litros por pessoa por dia.
Para saber se você e os membros de sua casa são consumidores moderados de água, faça o desafio 1. Se o resultado em sua casa for menor que 150 L por pessoa, significa que vocês praticam a economia de água. Se o resultado for entre 150 e 300 L é sinal de que vocês estão no limite do bom senso. Mas se passar de 300 L, significa que vocês devem refletir sobre a utilização da água na sua casa, ou mesmo averiguar se este elevado consumo não seria por causa de vazamentos.
Topo
Como é feito o tratamento de água?
Quase toda água potável que consumimos se transforma em esgoto que é re-introduzido nos rios e lagos. Estes mananciais, uma vez contaminados, podem conter microorganismos causadores de várias doenças como a diarréia, hepatite, cólera e febre tifóide. Além dos microorganismos, as águas dos rios e lagos contêm muitas partículas que também precisam ser removidas antes do consumo humano. Daí a necessidade de se tratar a água para que esta volte a ser propícia para o consumo humano.Quando pensamos em água tratada normalmente nos vem à cabeça o tratamento de uma água que estava poluída, como o esgoto, para uma que volte a ser limpa. Cabe aqui fazer uma distinção entre tratamento de água e tratamento de esgoto: o tratamento de água é feito a partir da água doce encontrada na natureza que contém resíduos orgânicos, sais dissolvidos, metais pesados, partículas em suspensão e microorganismos. Por essa razão a água é levada do manancial para a Estação de Tratamento de Água (ETA). Já o tratamento de esgoto é feito a partir de esgotos residenciais ou industriais para, após o tratamento, a água poder ser re-introduzida no rio minimizando seu impacto ao ambiente. Podemos dividir o tratamento de água em duas etapas, as quais chamamos de tratamento inicial e tratamento final:
Topo
Tratamento inicial:
Não há reações químicas envolvidas, somente processos físicos.- peneiramento: elimina as sujeiras maiores.
- sedimentação ou decantação: pedaços de impurezas que não foram retirados com o peneiramento são depositados no fundo dos tanques.
- aeração: borbulha-se ar com o intuito de retirar substâncias responsáveis pelo mau cheiro da água (ácido sulfídrico, substâncias voláteis, etc).
Tratamento final:
- coagulação ou floculação: neste processo as partículas sólidas se aglomeram em flocos para que sejam removidas mais facilmente.
Primeiramente, o pH da água tem que ser elevado pela adição ou de uma base diretamente, ou de um sal básico conhecido como barrilha (carbonato de sódio):
base:
NaOH(s) → Na+(aq) + OH-(aq)
sal básico:
Na2CO3(s) → 2 Na+(aq) + CO32-(aq)
CO32-(aq) + H2O(l) → HCO3-(aq) + OH-(aq)
Após o ajuste do pH, adiciona-se o sulfato de alumínio, que irá dissolver na água e depois precipitar na forma de hidróxido de alumínio. dissolução:
Al2(SO4)3(s) → 2 Al3+(aq) + 2 SO43-(aq)
precipitação:
Al3+(aq) + 3 OH-(aq) → Al(OH)3(s)
- sedimentação: os flocos formados vão sedimentando no fundo do tanque “limpando” a água.
- filtração: a água da parte superior do tanque de sedimentação passa por um filtro que contém várias camadas de cascalho e areia, e assim retiram as impurezas menores.
- desinfecção: é adicionado na água um composto bactericida e fungicida, como por exemplo o hipoclorito de sódio (água sanitária, NaClO), conhecido como ‘cloro’.
Topo
©2006 LaQA - Laboratório de Química Ambiental






0 comentários:
Postar um comentário